
Gå tillbaka
Hypoglykemi vid insulinbehandling - ett huvudproblem för personer med typ 1 diabetes
Professor emeritus Ulf Adamson, Institutionen för kliniska vetenskaper, Karolinska Institutet, Stockholm
Kära vänner!
SFD har förärat mig titeln hedersledamot i föreningen, vilket naturligtvis gläder mig mycket. Jag har också, i anledning därav, erbjudits att skriva en artikel i DiabetologNytt, och mitt val faller då på ämnet hypoglykemi vid insulinbehandling. Varför? Jo – trots att införandet av insulin var ett av de största medicinska framstegen under det förra seklet, så är hypoglykemi insulinbehandlingens oskiljaktiga följeslagare från allra första början. Hypoglykemi har också varit ett huvudtema i min forskning de senaste 30 åren. I det följande kommer jag därför att försöka förmedla en bild av problemet hypoglykemi utgående huvudsakligen från mina och mina medarbetares arbeten.
En anledning att jag här vill fokusera på ”problemet” hypoglykemi är att många av oss möjligen lever i den tron att problemet under senare år har minskat i betydelse, tack vare förbättringar i vården i form av fler och bättre mätinstrument för självkontroller av P-glukos, fler patienter på insulin flerdos terapi, införandet av humaninsulin, direktverkande analog-insulin och långverkande analog-insulin, att fler patienter som använder insulinpump samt vidare intensifierade satsningar på undervisning av patienter och anhöriga. Är det så? Har prevalensen av hypoglykemi minskat?
För att söka svar på denna fråga gjorde vi en tvärsnittsundersökning av samtliga våra patienter med typ 1 vid Danderyds sjukhus 1998, och jämförde resultaten med en tidigare identisk genomgång gjord 14 år tidigare (1984) (51). Undersökningen visade dels att den metabola kontrollen något förbättrats, men också att den rapporterade förekomsten av allvarliga tillbud av hypoglykemi (definition se nedan) var nästan identisk, med en prevalens på ca 20 % vid de båda undersökningstillfällena. Svarsfrekvensen vid både dessa tillfällen var god och låg på ca 80 %. Tillbud av allvarlig hypoglykemi tycks således inte ha minskat med ”modern” behandling i någon nämnvärd grad, och hypoglykemi i form av allvarliga tillbud (se nedan) kvarstår som ett betydande bekymmer, som begränsar vår förmåga att uppnå uppsatta behandlingsmål (54).
Ytterligare en lärdom från denna uppföljning var att hos de individer (n=8) som deltog vid båda dessa undersökningstillfällen hade tillbuden med allvarlig hypoglykemi nära fördubblats under de 14 åren(51). Detta illustrerar att ju längre man lever med sjukdomen insulinbehandlad diabetes, desto vanligare blir problemet hypoglykemi! Detta återkommer jag till nedan.
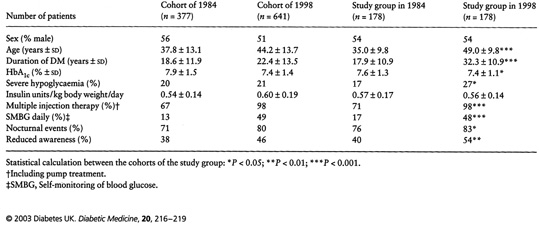
Bild 1. Prevalens av allvarlig hypoglykemi 1984 resp. 1998(51)
Några definitioner - Vad är hypoglykemi?
Biokemisk hypoglykemi = P-glukos <4mmol/L
Hypoglykemi är det utan tvekan vanligaste komplikationen till insulinbehandling, och också det diabetesrelaterade problem som personer med diabetes känner mest oro inför(32), eftersom i princip alla drabbas.
När blodsockerhalten sjunker under den normala nivån (mellan 3-4 mmol/l) uppträder hos friska icke diabetiker olika symptom som kan uppfattas som varningssignaler (s.k. adrenerga symptom som hjärtklappning, svettningar, irritabilitet, oro, tremor, blek ansiktsfärg) och/eller tecken på nedsatt CNS funktion (s.k. neuroglukopena symptom, som trötthet, huvudvärk, passivitet, kramper, sluddrigt tal, försämrad muskulär koordination och så småningom medvetslöshet). Hos äldre personer med diabetes kan diabetes med neuroglukopena symptom av hypoglykemi missuppfattas som stroke.
Ett problem med de adrenerga symptomen hos personer med diabetes, är att de är vanliga och ospecifika och kan förväxlas med andra situationer än hypoglykemi. Vidare förkommer det å andra sidan inte sällan (hos ca 30 %) att personer med diabetes inte upplever typiska varningssymptom, trots uppmätt P-glukosnivå på <3,0 mmol/l , ett tillstånd som i engelskspråkig litteratur benämnas hypoglycemia unawareness, och på svenska hypoglykemisk omedvetenhet(53).
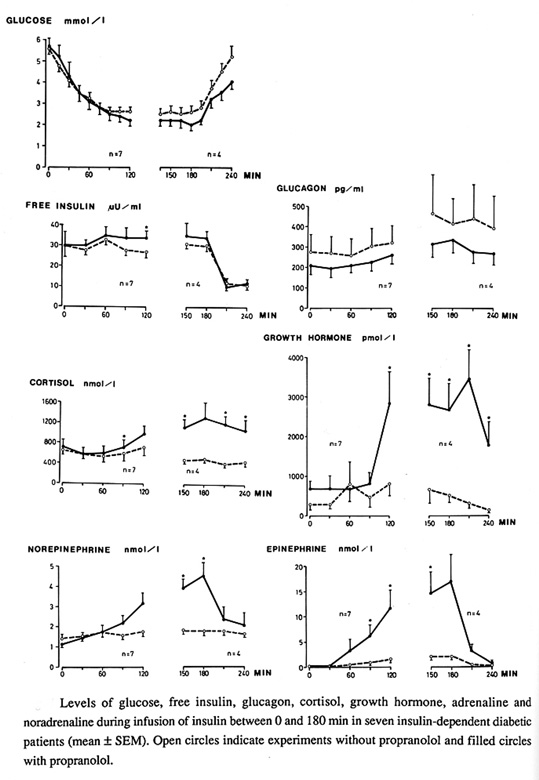
Bild 2. Effekt av oselektiv betablockad (propranolol) på hormonell motregulation av hypoglykemi vid T1 diabetes(56). Notera djupare hypoglykemi och förlångsammad restitution.
Unawareness of hypoglycaemia = hypoglykemisk omedvetenhet
= No symptoms at a p-glucose of less than 3 mmol/L
Ytterligare en komplicerande faktor är att minst 50 % av alla tillbud av uttalad hypoglykemi, inträffar under natten när patienten sover. I litteraturen är man ofta försiktig med att redovisa milda tillbud av hypoglykemi p.g.a. svårigheter att korrekt kvantifiera dess förekomst. I stället brukar man försöka identifiera tillbud av allvarlig hypoglykemi, ett tillstånd som definieras med att patienten inte själv kan vidta motåtgärder, utan hjälp krävs av utomstående, allt ifrån hjälp av anhöriga till besök på akutmottagningen). Prevalensen av minst ett sådant allvarligt tillbud per år brukar anges till mellan 10-30%. Upprepade allvarliga tillbud förekommer hos ca 4% av våra patienter(22).
Varför Hypoglykemi?
Man kan undra om det, utifrån kliniska parametrar, går att identifiera patienter med ökad risk för hypoglykemi. Frånsett mer uppenbara orsaker till hypoglykemi såsom förekomst av hypothyreos, eller cortisolbrist, hypofysinsufficiens, sjukdomar i mag-tarmkanalen och pankreas, alkoholmissbruk och användandet av oselektiva beta blockare (56)( se bild 2) är förklaringsunderlaget svagt. Vid hypothyreos förefaller en del av förklaringen vara minskad nedbrytning av insulin (leder till högre insulinnivåer) och en försämrad förmåga att stegra glukagon (10)(se bild 3).
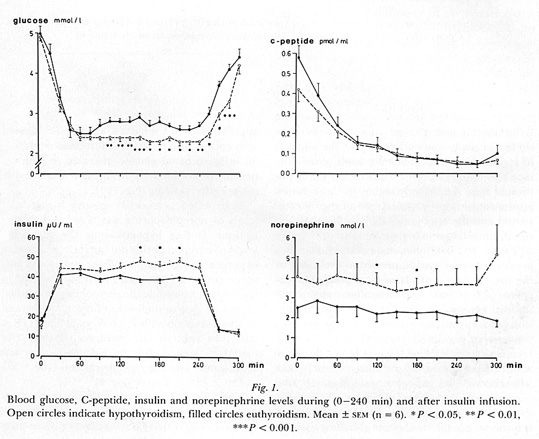
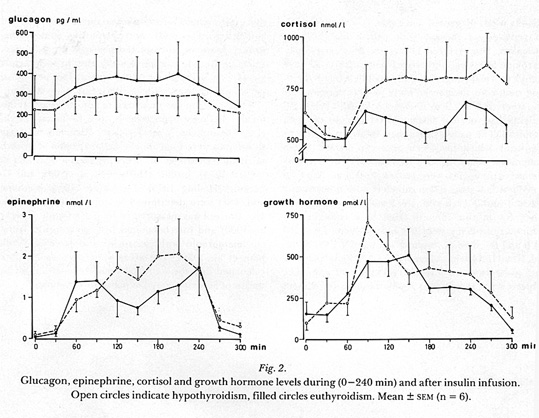
Bild 3. Motregulation vid hypothyreos(10). Notera högre insulin, lägre glukagon och lägre glukosnivå.
De faktorer som brukar återkomma vid analys av patienter med allvarliga tillbud är lägre HbA1c, lång sjukdomsduration, upprepade allvarliga tillbud, förekomst av hypoglykemisk omedvetenhet samt oro och ångest (32,44,56,57).
Dessutom förefaller det att patienter med allvarliga tillbud, kanske inte oväntat, oftare gör självkontroller av p-glukos. Labil glukoskontroll,(kan exempelvis kvantifieras genom att beräkna SD av ett stort antal P-glukosmätningar) relaterar också till hypoglykemi (37). Det finns fallbeskrivningar där förekomst av insulinbindande antikroppar tycks genera tillbud av hypoglykemi, troligen genom påverkan på farmakokinetiken av insulin. Vid en genomgång av vara patienter fann vi dock inte något sådant samband mellan förekomst av antikroppar och tillbud av hypoglykemi (22,23,44,51,56,57).
Sammantaget kan dock dessa riskfaktorer förklara mindre än 15-20% varför vissa individer drabbas oftare än andra(51). Skälet till att lång sjukdomsduration disponerar till ökad risk till hypoglykemi är inte klarlagd, men man har bl.a. funderat över eventuella samband med neuropati, som skulle kunna funktionellt drabba den hormonella motregulationen (och då speciellt adrenalinfrisättningen vid hypoglykemi). Se mer om detta nedan.
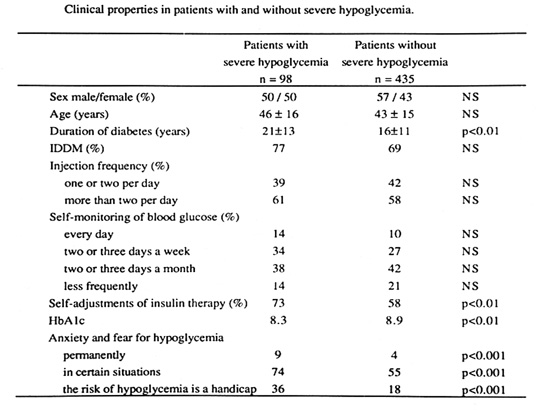
Bild 4. Riskfaktorer för allvarlig hypoglykemi (56,57)
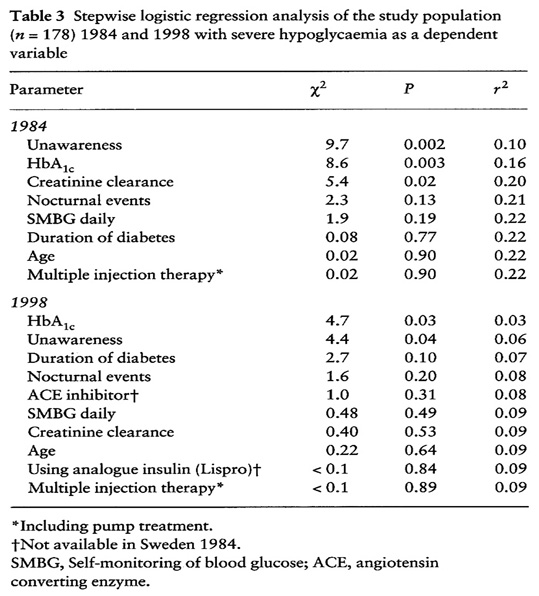
Bild 5. Riskfaktorer (stegvis regressionanalys) för allvarlig hypoglykemi (51)
Den hormonella motregulationen hos friska
Hos friska individer styrs den basala glukoshomeostasen genom en balans mellan insulin och glukagon (5), där även små förändringar i hormonhalterna påverkar glukosnivån. Vid hypoglykemi stängs omedelbart insulinfrisättningen av, vilket troligen är den viktigaste komponenten att motverka hypoglykemi, samtidigt som glukagonnivåerna stiger. Av viss betydelse kan vara att hypoglykemi i sig inte påverkar metabolismen/nedbrytningshastigheten av insulin (27).
I samband med hypoglykemi sker frisättning av en karskad av hormoner, såsom glukagon, adrenalin, noradrenalin, GH, cortison, panceratisk polypeptid och somatostatin, men av dessa tycks enbart glukagon och adrenalin ha någon mer betydande roll i den akuta motregulationen av hypoglykemi.
Glukagon ökar glukosproduktionen från levern genom att stimulera nedbrytning av glycogen och nytillverkningen av glukos via gluconeognesen. Glukagon är dock inte helt essentiell i motregulationen av hypoglykemi, vilket kan illustreras i experiment hos friska där glucagon-insöndringen blockeras med somatostatin, p.g.a. att kroppen då i stället mobiliserar glukos med hjälp av en mer uttalad stegring av adrenalin (4,9). Notera dock att den maximala hypoglykemiska nivån i en situation utan glukagon, blir något lägre än med glukagon närvarande. (Bild 6)
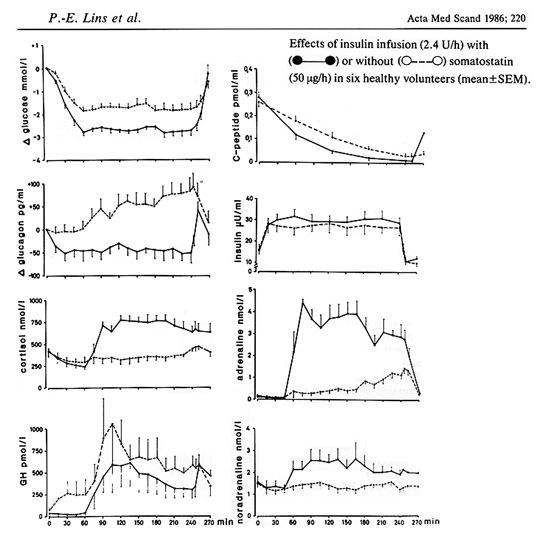
Bild 6. Motregulation i avsaknad av glukagon hos friska, notera den kraftiga ökningen av adrenalin, och att blodsockersänkningen blir med uttalad (9)
Effekten av glukagon förefaller vidare att vara tidsbegränsad, eftersom den stimuleringen av glukosproduktionen från levern tycks upphöra inom loppen av någon timma, vilket experiment med hypoglykemi +somatostatin+ exogen tillförsel av glukagon, har visat (9). Återigen, även här tar adrenalin över som huvudsaklig motregulator av insulininducerad hypoglykemi. (Bild 6)
Samma förhållande gäller om kroppen exponerats för förhöjda glukagonnivåer under en tid före den hypoglykemiska perioden (12). Vid sidan av den avstängda insulinproduktionen, spelar således glukagon och adrenalin huvudroller i kroppens försvar mot hypoglykemi. Magnituden av stegringen av dessa båda hormoner beror på graden och durationen av hypoglykemin.
Den hormonella motregulationen hos personer med typ 1 diabetes
Det viktigaste skälet för benägenheten till hypoglykemi hos typ 1 diabetiker är utan tvivel att de inte, av uppenbara skäl, kan sänka sina insulinnivåer vid lågt blodsocker.
Mot bakgrund av detta förefaller det logiskt att försöka hålla de cirkulerande nivåerna av insulin mellan måltiderna på lägsta möjliga nivå. Hur detta skall kunna ske är dock inte enkelt eller självklart med dagens terpi-arsenal. Vad gäller den hormonella motregulationen är insöndringen av GH och cortison i huvudsak normal även efter mycket lång sjukdomsduration, men dessa hormoner har begränsad betydelse i motregulationen. Vad gäller glukagon och adrenalin är situationen mer komplicerad. Ofta beskrivs att glukagon insöndringen, som svar på hypoglykemi, helt upphör några få år efter sjukdomsdebuten, medan den är bibehållen efter stimulering med andra sekretagoger som med aminosyran arginin (48). Sådana iakttagelser är oftast baserade på studier där insulin injicerats i.v. i hög bolusdos, som resulterar i kortvarig hypoglykemisk episod. Trots utebliven glukagoninsöndring sker restitutionen av blodglukos dock med normal hastighet, vilket förklaras av att insulinhalten snabbt klingar av efter injektionen, samt att det sker frisättning av adrenalin (18).
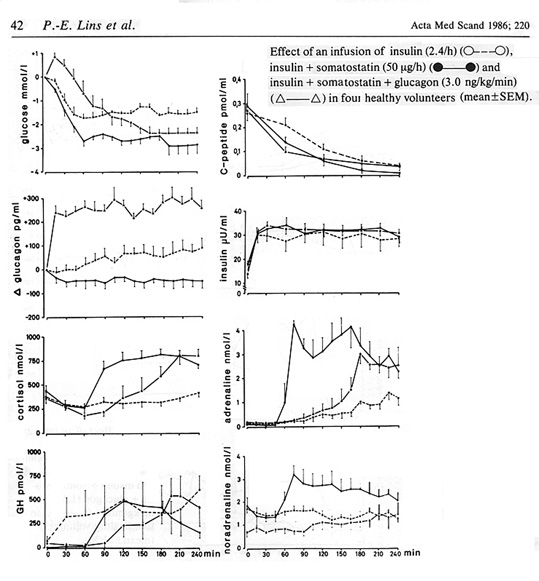
Bild 7. Motregulation med tillägg av exogent glukagon under 4 timmar (9). Notera att glukos initialt stiger, men sedan sjunker trots närvaro av hög glukagonhalt.
Under andra experimentella betingelser får man en något annorlunda bild, exempelvis när man tillför insulin som i.v. infusion under några timmar, med en mer modest höjning av insulinhalten, och samtidigt ett mer långvarigt hypoglykemisk tillstånd. Den bild som då framträder är att flertalet personer med typ 1 diabetes med en sjukdomsduration under 20 år, kan frisätta glukagon i viss omfattning. Dock inträffar detta vid en något lägre blodsockerninvå än vid motsvarande förhållanden hos friska (35). Restitutionen av blodsockret när insulininfusionen avbröts är normal liksom frisättningen av adrenalin. Skillnaden diabetiker mot friska synes därför delvis bestå i att tröskelvärdet för aktivering av glukagonfrisättningen är sänkt vid diabetes.
Hos en mindre grupp personer med diabetes, ofta med anamnes av upprepade tillbud av allvarlig hypoglykemi synes också tröskelvärdet för aktiveringen av adrenalin, vara sänkt, vilket resulterar i en uppenbarligen defekt hormonell motregulation, och defekt förmåga att restituera normoglykemi. Dessa patienter hör också till gruppen med hypoglykemisk omedvetenhet, och riskerar därför att drabbas av medvetslöshet p.g.a. hypoglykemi utan föregående varning(6)(Bild 12).
Ingen har hitintills helt kunnat förklara denna defekta hormonella motregulation, som således drabbar förmåga att adekvat stegra såväl glukagon som adrenalin. Man har spekulerat i om en autonom neuropati skulle orsaka tillståndet, men inga övertygande belägg har presenterats. Frisättningen av pankreatisk polypeptid (PP) vid hypoglykemi brukar relatera till neuropati, men det tycks inte finnas några samband mellan bristfälligheter i PP respektive glukagoninsöndring (35).
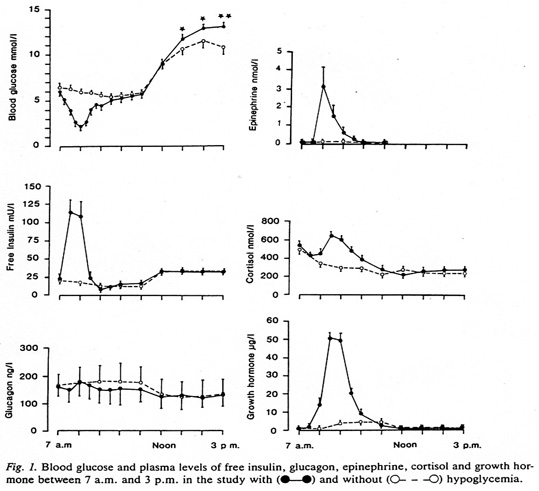
Bild 8. Motregulation (notera avsaknad av glukagon-stegring) hos T1 diabetiker efter injektion av bolusdos insulin (18).
Även om glukagon inte är helt essentiell för effektiv motregulation, förutsatt att adrenalinfrisättningen är intakt, så har intresset bakom den defekta glukagoninsöndringen varit mycket i fokus. Eftersom den defekta insöndringen av glukagon inträder efter debut av diabetessjukdomen, har man utan framgång sökt samband med den avtagande frisättningen av insulin, eller C-peptid (58). Inte heller C-peptid i sig (40) eller användandet av porcint, humant semisyntetiskt insulin tycks ha någon effekt på glukagoninsöndringen, trots rykten initialt att humaninsulin negativt befarades försämra symptom och motregulation vid hypoglykemi(25) (Bild 11). Den stimulerade glukagoninsöndringen (efter tillförsel av aminosyran arginin) dämpas om glukosnivån stegras. Samma sak inträffar om glukosnivån varit stegrad före stimuleringsfasen, talande för någon form av metabolt minne(1). Man skulle därför kunna förmoda att graden av glycemi vid T1 diabetes före den hypoglykemiska episoden, skulle kunna vara av betydelse för glukagoninsöndringen, men så tycks inte vara fallet eftersom förbättring (till nåra normoglykemi) av den metabola kontrollen kan inte förbättrade/påverkade situationen (7) (Bild 13). Eftersom dessa patienter drabbas av upprepade svåra tillbud har vi och andra spekulerat över om hypoglykemisk omedvetenhet kan vara orsakad av tidigare tillbud. Benägenheten till defekt hormonell motregulation och hypoglykemisk omedvetenhet förefaller vara en permanent defekt, när den väl blivit etablerad. Som stöd för detta påstående har vi visat att reaktionsmönstret är reproducerbart i hög grad vid medvetet utlöst hypoglykemi under kontrollerade förhållanden inom loppet av flera år, och detta trots att antalet tillbud genom olika åtgärder markant minskade i frekvens (44).
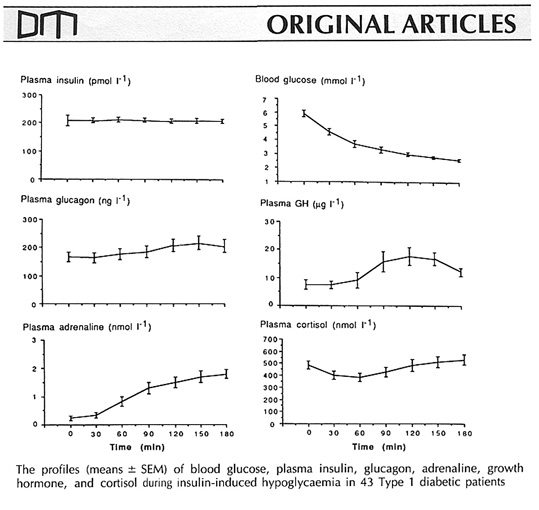
Bild 9. Motregulation hos T1 diabetiker av prolongerad hypoglykemi (notera att en viss ökning av glukagon sker) utlöst av infusion av insulin (35)
En ytterligare faktor som det spekulerats kring är om somatostatin som bl.a. frisätts från delta cellerna i ö-cellsorganet, i sig en mycket potent hämmare av glukagonfrisättningen (liksom insulinfrisättningen) här skulle kunna vara av betydelse. Faktum är att frisättningen av somatostatin ökar under hypoglykemi(se bild 11 och 15). Dessutom tenderar de cirkulerande nivåerna av somatostatin att stiga till något mer hos personer med typ 1 diabetes jämfört med friska (30,31).
En känd faktor som kan påverka glukagonsvaret är emellertid insulin i sig, p.g.a. att insulin tycks kunna hämma insöndringen av glukagon. Således finns evidens hos friska, att stegring av insulinhalten via oralt glukosintag, hämmar en efterföljande stimulering av glukagoninsöndringen med aminosyran arginin(2).
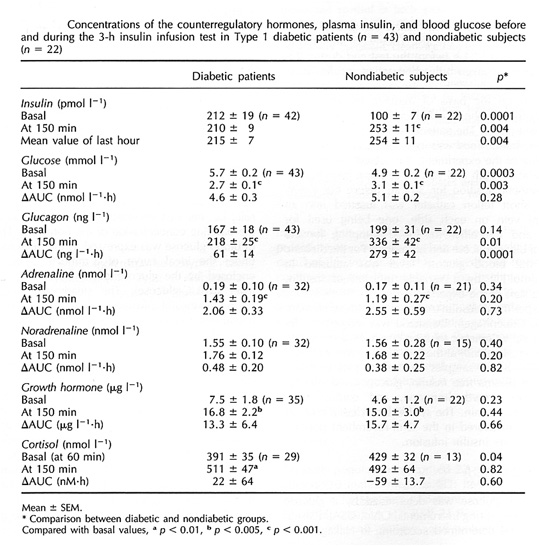
Bild 10. Motregulation hos personer med diabetes jämfört med friska kontroller (35)
Likaledes sänks glukagoninsöndringen vid hypoglykemi av höga cirkulerande nivåer av insulin, såväl hos friska som hos personer med diabetes (30,31,35). Vid genomförandet av dessa experiment var det avgörande att den hypoglykemiska situationen var identisk, varför experimenten genomfördes med hypoglykemisk clampteknik baserad på mätningar av de arteriella glukosnivåerna(30,31,33,34).
Det har även visats att det finns ett negativ samband mellan insulinhalten, även inom den ”terapeutiska nivån” hos personer med typ 1 diabetes, och glukgonsvaret vid hypoglykemi (34, Bild 16).
En förklaring till detta kan vara att glukagon frisättningen från alfa cellerna i ö-cellsorganet normalt står under inflytande av den lokala parakrina miljön. Blodtillförseln till ö-cellsorganet sker på så sätt att blodet först når de centrala delarna, där huvuddelen av de insulinproducerande beta-cellerna finns. Blodet strömmar sedan ut mot periferin i organet och insulin når därefter de glukagon-producerande alfa-cellerna. Förutsättningar finns därför att insulin, antingen tillfört exogent eller frisatt endogent från betacellerna skulle kunna påverka alfa-cellerna. Att en parakrin hämning av insulin på glukgonfristättningen föreligger stöds av experiment på personer med typ 2 diabetes, där insulinutöst hypoglykemi i närvaro och frånvara av en sulfonylurea. Undersökningen visade sänkt glukagonfrisättning under identisk hypoglykemi och perifer hyperinsulinemi, i närvaro av sulfonylurea (45). Vi tolkar resultaten från denna studie så att den endogena insulin produktionen, mätt som förhöjd halt av C-peptid, lokalt hämmade insöndringen av glukagon. Situationen hos personer med typ 1 diabetes är naturligtvis helt annorlunda, eftersom den endogena insulinproduktionen i princip upphört.
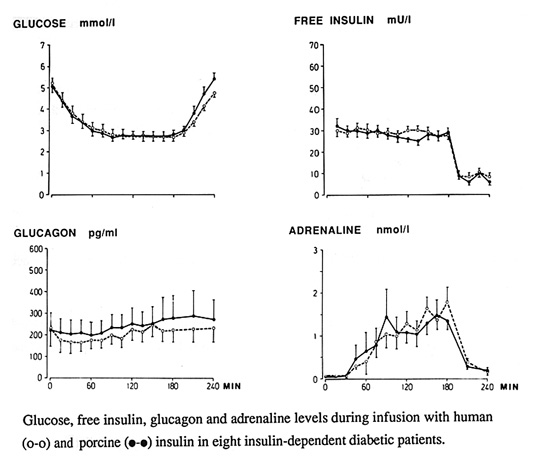
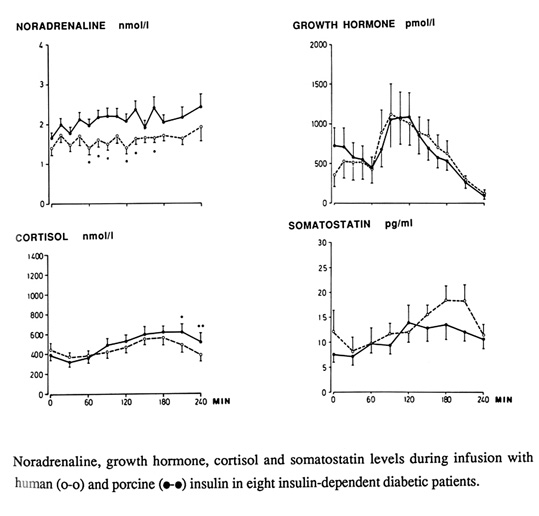
Bild 11. Hormonell motregulation utlöst av svininsulin jämfört med humaninsulin (ingen skillnad!) (25).
Man kan naturligtvis här spekulera i om alfacellerna kan ändra sin känslighet för insulin beroende p.g.a. tillgången/ förmågan att frisätta insulin. Som visst stöd för denna hypotes kan anföras att personer med extrem övervikt, i motsats till situationen vid typ 1 diabetes, kan frisätta glukagon vid hypoglykemi trots extremt höga cirkulerande insulinnivåer. Hos dessa individer är som bekant förmågan till endogen hyperinsulinemi markant ökad, vilket hypotetiskt skulle kunna tänkas resultera i att alfa-cellerna här adapterar sig till lokalt hög insulinhalt, och därmed blir mer okänsliga för insulinets inhibitoriska effekt (52).
Flertalet gravida diabetiker uppnår idag nära normal glukoskontroll och därmed få diabetesrelaterade komplikationer tack vare hög motivation, täta vårdkontakter, frekvent självkontroll av P-glukos och ständig anpassning av insulindosen. Risken för hypoglykemi ökar men det har varit oklart om hypoglykemiska symptom och motregulation avviker från situationen utan graviditet. Efter noggrann etisk prövning fick vi möjlighet att under kontrollerade betingelser utlösa hypoglykemi (hypoglykemisk clamp med insulininfusion och arteriella glukosmätningar) dels under sen graviditet (tredje graviditetstrimestern) dels 5-13 månader post partum. Studien visade att motregulation var mycket likartad i de båda situationerna (41)(Bild 18). Den kanske mest betydande skillnaden var att GH insöndringen under graviditet var betydligt lägre. Under graviditet bildas GH inte bara i hypofys utan även i placenta, och med särskild metodik går det att skilja hypofysärt och placentärt GH åt.
Studien visade att placenta deltar i motregulationen mot hypoglykemi, eftersom placentärt GH stegrades i samband med hypoglykemi (41). Studien visade också att nedbrytningshastigheten av insulin var betydligt lägre under graviditeten, vilket resulterade i högre cirkulerande insulinnivåer (43)(Bild 17). Några varningssymptom var något mindre uttalade under graviditet, nämligen bultande hjärta, huvudvärk och oförmåga att koncentrera sig, vilket skulle kunna bidra till ökad risk för hypoglykemi. Övriga symptom såsom svettning, skakighet, hunger och stickningar runt mun skiljde dock inte mellan undersökningarna (41). Barnet (intrauterint) reagerade inte ogynnsamt på hypoglykemi, baserat på registrering av barnets hjärtfrekvens respektive umbilikal-artärens velocity waveform mätt med Doppler-ultraljudsteknik (39).
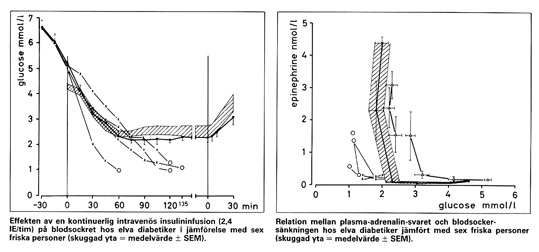
Bild 12. Defekt adrenalinfrisättning hos fyra personer med diabetes jämfört med flertalet diabetiker resp. friska(6,8)
Är hypoglykemi farligt? Konsekvenser av hypoglykemi
Vid en normal blodsockernivå innehåller blodbanan ca 5 g glukos, samtidigt som den basala konsumtionen av glukos uppgår till ca 10 g/timme. Hjärnan har små lager av näringsämnen och är därför beroende av en konstant tillförsel av glukos för att fungera normalt, eftersom hjärnan nästan uteslutande använder glukos för sin metabolism. Vid fasta kan dock också ketonkroppar utnyttjas (14,21).
Transporten av glukos till hjärnan sker oberoende av insulin, varför kroppen utvecklat ett system med hormonell motregulation i syfte att förhindra hypoglykemi. Långvarig och djup hypoglykemi kan leda till bestående allvarlig hjärnskada och kan även leda till döden. Man brukar ange att 3-5% av personer med typ-1 diabetes dör i hypoglykemi. I jämförelse med andra läkemedel kan denna siffra anses hög. En dödsorsak vid sidan av allvarlig hjärnskada som diskuterats (46) skulle kunna vara att hypoglykemin via bl.a. katekolaminfrisättning utöser fatalt kammarflimmer. Vid sidan av dödsfall kan sannolikt frekventa allvarliga tillbud också ge upphov till mindre allvarliga men bestående CNS skador, som kan yttre sig i nedsatt kognitiv förmåga (24). Hypoglykemi ger även upphov till oro, ängslan (32) och depression såväl hos patient som anhöriga. Hos vissa kan denna oro och ängslan resultera i att patienterna uppvisar höga/otillfredsställande HbA1c värden (60), kanske beroende på att de medvetet av och till undviker att ta ordinerade insulindoser. Hos personer med T1 diabetes, utan kliniska tecken till neuropati (normala cariovaskulära reflexer d.v.s. respiratorisk sinus arrhytmi och valsalva ratio var normala) uppvisade avsaknad av det normala vasocontrictor reaktionen i hudens mikrocirkulation i samband med hypoglykemi (36). Förklaringen och betydelsen av denna avvikelse från det normala är inte klarlagda.
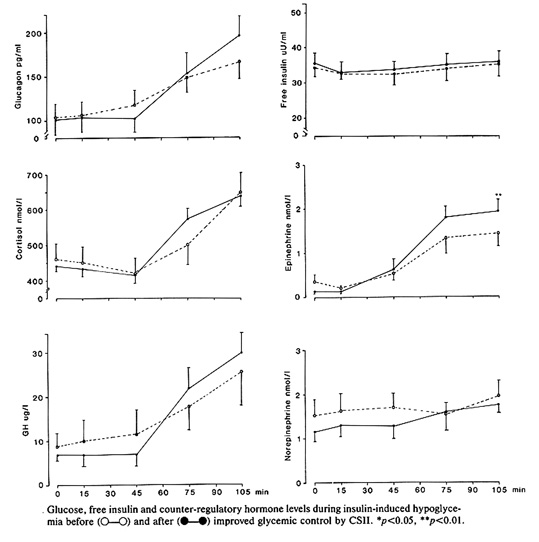
Bild 13. Effekt av nära normalisering av den metabola kontrollen (eller kanske snarare avsaknad av effekt) på motregulation av hypoglykemi efter övergång till insulinpumpbehandling (7).
Hypoglykemi kan också i efterförloppet ge upphov till stegrade blodsockernivåer, s.k. posthypoglykemisk hyperglykemi (19), och därmed bidra till en mer instabil och ”svängig” sockerbalans. Även om vanligheten och magnituden av detta fenomen är under debatt(26), är det uppenbart att flera av aktörerna i den hormonella motregulationen ger upphov till efterföljande insulinresistens under åtskilliga timmar.
Ett av mina första arbeten på temat hypoglykemi visade att exogen tillförsel av tillväxthormon (GH) inte påverkade restitutionen av blodsockret efter insulinutöst hypoglykemi (3). GH har således ingen roll i den akuta motregulationen, men GH ger mer långsiktigt (efter en latens på 4-8 timmar) upphov till något mer markant hyperglykemi genom att inducera insulinresistens under den posthypoglykemiska perioden. Dessa resultat konfirmerades några år senare med mer sofistikerad metodik, där vi utnyttjade en i.v. cocktail bestående av somatostatin, insulin och glukos , s.k. SIGIT= somatostin-insulin-glucose-infusion-test, för att på ett standardiserat sätt kunna kvantifiera insulinkänsligheten under tid (16,19). Vi har också kunnat visa att inträdandet av den posthypoglykemiska insulinresistensen kan förhindras om GH insöndringen under hypoglykemi blockeras (18,20).
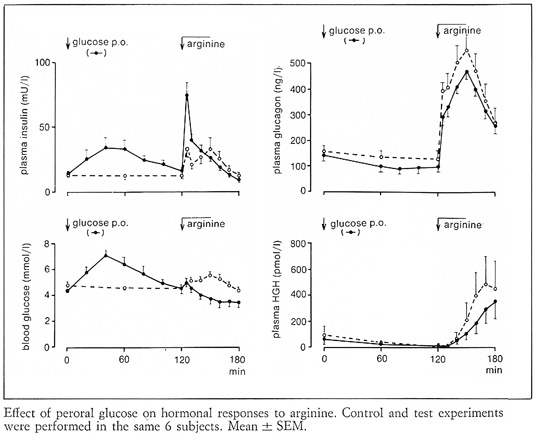
Bild 14. Bilden demonstrerar hur en oral glukosbelastning hämmar glukagoninsöndringen vid en efterföljande injektion av l-arginin (2).
Effekten av denna GH-inducerade insulinresistens är dock relativt måttlig, och uttryckt som en höjning av p-glukos brukar den uppgå till ca 5-6mmol/l (16,19). Även adrenalin ger upphov till posthypoglykemisk insulinresistens under upp till sex timmar, som dock kvantitativt är mindre påtaglig än den som GH ger upphov till, och cortison tycks åtminstone addera något till den insulinresistens som GH och adrenalin i sig ger upphov till (17).
Glukagon ger inte upphov till posthypoglykemisk rekyl. I diabetesvården har det understundom varit populärt att hänvisa till denna benägenhet till posthypoglykemisk hyperglykemi, den s.k. Somogyi-effekten (26), som generell förklaring till labil sockerkontroll. Ofta talar man om en hypoglykemisk rekyl, varvid man menar att blodsockret efter en hypoglykemi episod snabbt stiger till mycket höga värden. I det fall sådana rekyler uppstår i vaket tillstånd beror de troligen mera på ett överdrivet intag av snabba kolhydrater. Ibland har man även misstänkt nattlig hypoglykemi, under sömnen, som förklaring till markant hyperglykemi vid uppvaknandet på morgonen, men så är inte fallet eftersom kontinuerliga glukosmätningar visar att sådan nattlig hypoglykemi aldrig ger morgon hyperglykemi (16), snarast är blodsockret sådana mornar förhållandevis lågt. Den som vill läsa mer om Somogyi och rekylen kan finna detta i artikeln om ”mannen bakom syndromet” (26).
Svängigt socker relaterar mätt exempelvis som standarddeviation av ett stort antal egna p-glukosmätningar relaterar inte till HbA1c (37) men väl till såväl till allvarliga tillbud av hypoglykemi, liksom till hypoglykemisk omedvetenhet (37). Man har också spekulerat om stora svängningar i glukos i sig skulle kunna vara en riskfaktor/förklaringsgrund för uppkomst av sena diabeteskomplikationer. Vi har visat att så kan vara fallet åtminstone vad gäller de neuropatiska komplikationerna (59).
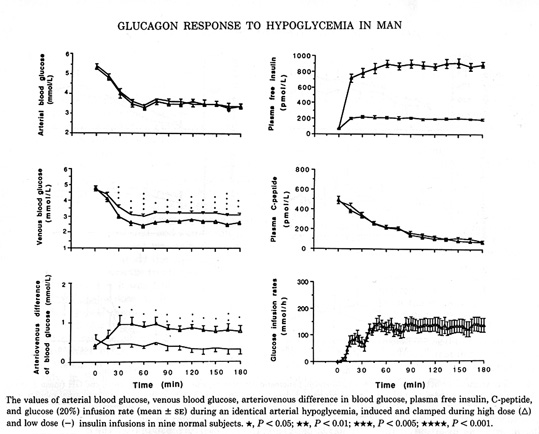
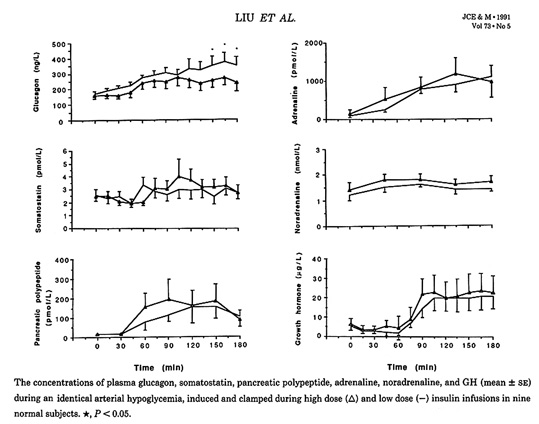
Bild 15. Bilden demonstrerar effekten av infusion av låg respektive hög dos av insulin på den hormonella motregulationen hos friska (notera hämningen av glukgoninsöndringen)(30).
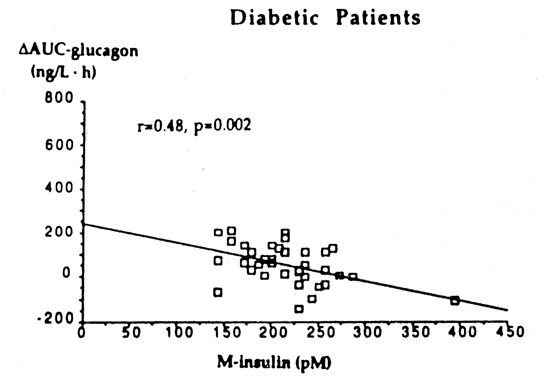
Bild 16. Bilden visar sambandet mellan frisättning av glukagon vid hypoglykemi och den jämviktsnivå av insulin som uppnåddes efter standardiserad i.v. infusion(35)
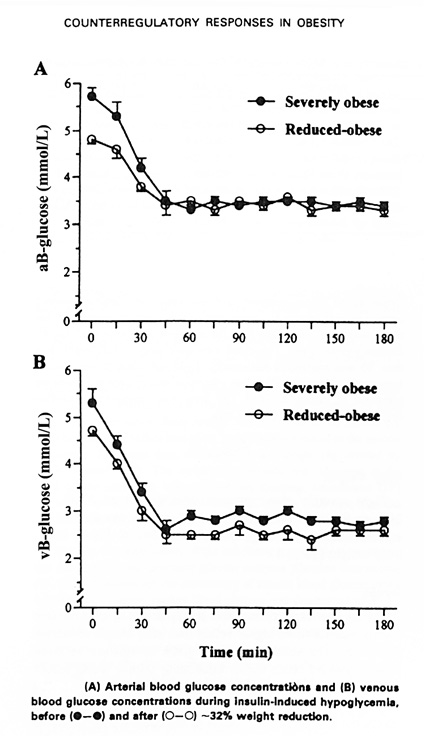
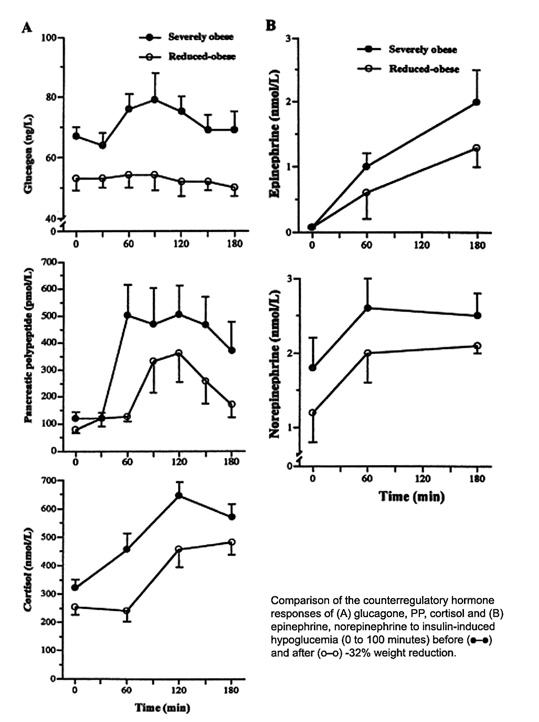
Bild 17. Motregulation av hypoglykemi vid extrem övervikt före och efter viktreducerande kirurgi
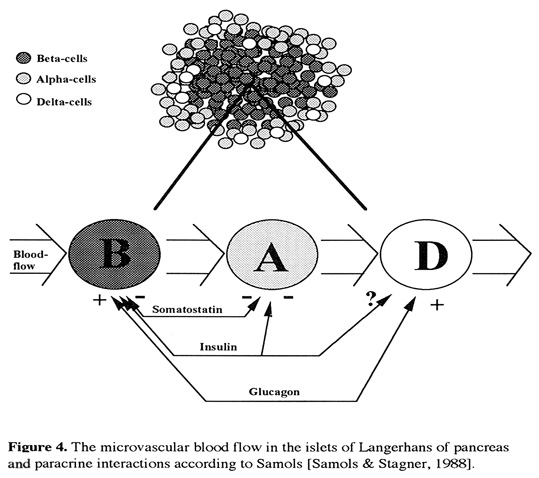
Bild 18. Funktionell uppbyggnad av det pankreatiska ö-cellsorganet (58). Den hormonella motregulationen hos personer med typ 1 diabetes och graviditet.
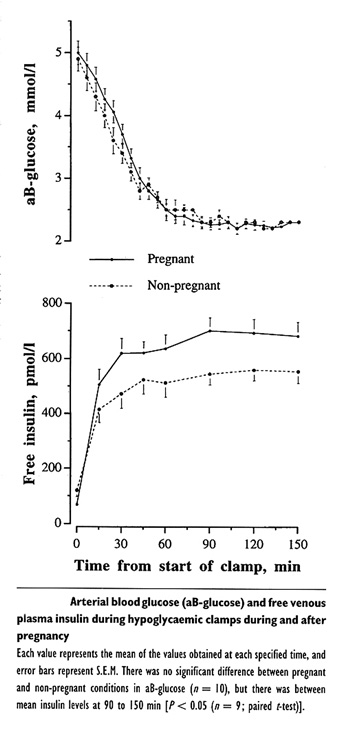
Bild 19. Motregulation av hypoglykemi hos typ 1 diabetiker under och efter graviditet . Bilden visar att nedbrytningen av insulin sker långsammare under graviditet vilket medför högre cirkulerande insulinnivåer (43)
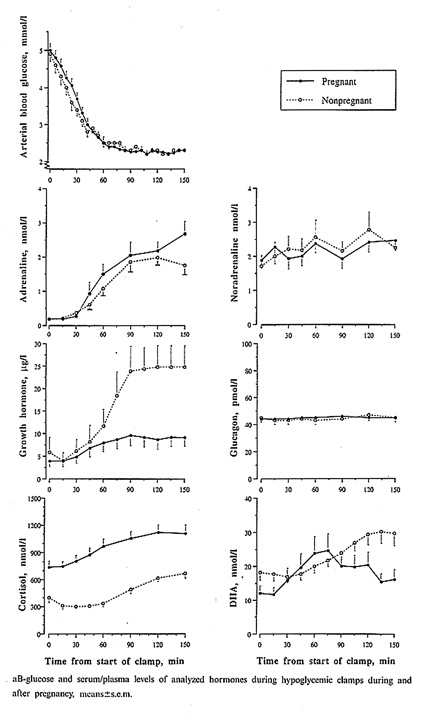
Bild 20. Motregulation av hypoglykemi hos T1 diabetiker under och efter graviditet (41)
Vad kan göras för att minska risken till hypoglykemi
En svårt drabbad grupp är de personer med upprepade allvarliga tillbud, ofta samtidigt med hypoglykemisk omedvetenhet. Frågeställningen hos dessa kanske angripas från flera olika utgångspunkter. Man kan således undra om något kan göras för att öka den hypoglykemiska medvetenheten, exempelvis genom att förstärka de hypoglykemiska varningssymptomen. Man skulle kanske också önska sig möjligheter att förbättra den hormonell motregulationen och då kanske främst ökad insöndring av adrenalin och glukagon. Det finns terapeutiska möjligheter att påverka situationen dels med s.k. cardioselektiva adrenerga beta-blockare, såsom metoprolol (13), eller med alfa2 blockare, typ idazoxan (38). Båda preparaten förstärker de adrenerga varningssymptom, kanske främst svettning. Vad gäller idazoxan, så förbättrades utöver adrenalininsöndringen också glukagonsinöndringen samtidigt som insöndringen av GH minskade. Trots lovade resultat har dock veterligen dessa terapier hitintill använts i mycket begränsad omfattning.
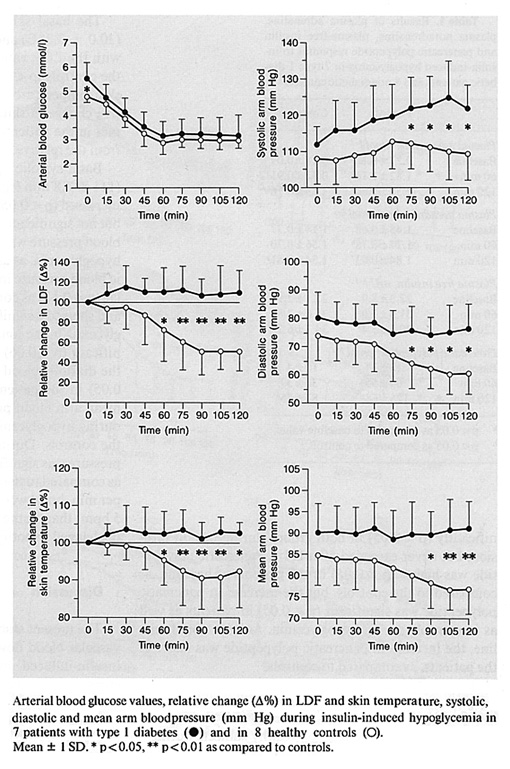
Bild 21. Effekt av hypoglykemi på hudens mikrocirkulation. En jämförelse mellan friska personer och personer med T1 diabetes (36).
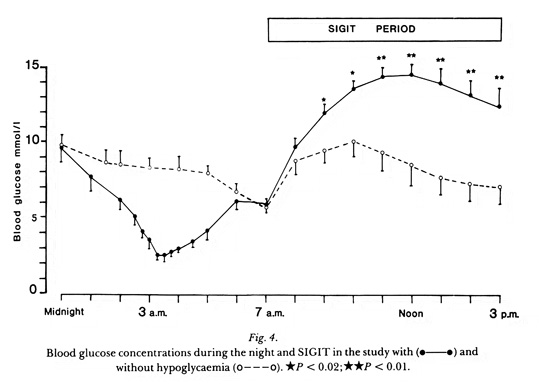
Bild 22. Blodsockerhalt med och utan nattlig hypoglykemi, med efterföljade test av insulinkänsligheten med hjälp av SIGIT (se text) (16)
En annan möjlighet som inom en framtid kan bli verklighet är kontinuerlig glukosmonitorering i real tid, med larm vid sjunkande eller låga glukosnivåer, och samtidigt avbrytande av insulintillförseln, om detta sker med glukosstyrd insulinpump. Tyvärr har dock tekniken fram tills nyligen varit behäftad med betydande felkällor och begränsad driftstid (55).
Eftersom insulin själv, av vad som framgått ovan, uppenbarligen är en huvudaktör bakom såväl uppkomst av hypoglykemi, liksom också indirekt genom inhibition av glukagon, kan man ur ett mer generellt perspektiv undra över eventuella möjligheter att förbättra insulinbehandlingen i sig. För att minska risken för hypoglykemiska tillbud bör man syfta till att hålla insulinnivåerna rimligt låga under natten och mellan måltiderna. Utan tvivel har införandet av långverkande insulinanaloger (utan ”peak” i farmakokinetiken), liksom användandet av s.c. insulinpump, i viss mån reducerat risken för främst nattliga tillbud. Av vad som framgått i ovan är dock fortfarande frekvensen av hypoglykemi hög, särskilt om ambitionen är att uppnå uppsatta behandlingsmål (50,54)!
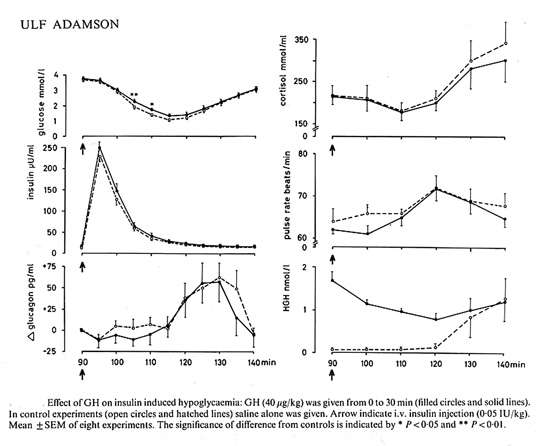
Bild 23. Effekt av exogent GH på blodsockernivån under och efter hypoglykemi (3)
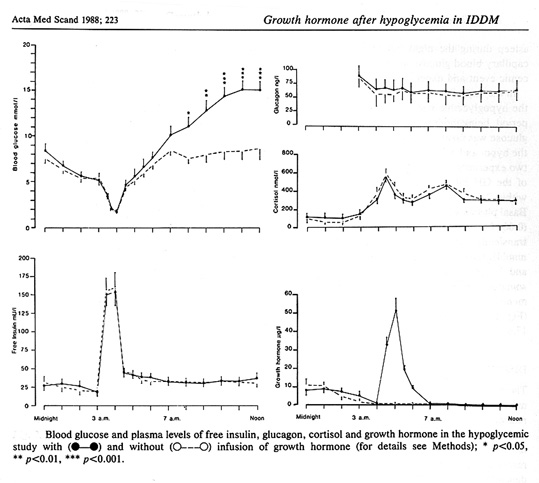
Bild 24. Effekt av exogent GH på blodsockernivån under och efter hypoglykemi (18)
En förklaring kan vara att insulin tillfört via den s.c. vägen uppenbarligen är helt ofysiologisk, eftersom insulinets huvudsakliga målorgan är levern. Ett sätt att bättre efterlikna den fysiologiska verkligheten är att tillföra insulin i bukhålan, endera via port i bukväggen (28), eller via implanterbar insulinpump (47,48,49). Intraperitoneal insulinbehandling förefaller markant minska risken för hypoglykemi, vilket delvis kan tillskrivas mer reproducerbara insulinprofiler efter injektion (29), men också p.g.a. betydligt lägre systemiska insulinnivåer mellan måltider och under natten (47,48,49).
Våra studier visar också att glukagoninsöndringen under hypoglykemi förbättrades efter övergång från behandling med s.c. insulinpump till Intraperitoneal tillförsel med implanterbar pump. En bidragande förklaring kan här vara de lägre nivåerna av insulin, som således utöver en lägre grad av inhibition på alfacellernas förmåga att frisätta glukagon (47,48,49).
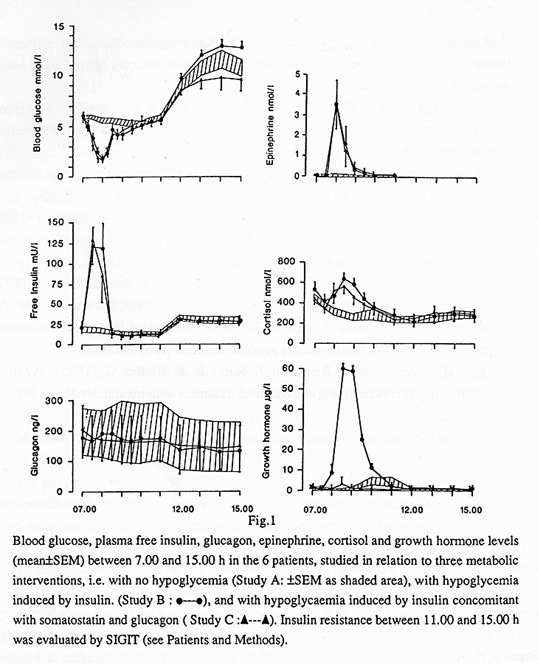
Bild 25. Effekt av blockering av insöndringen av GH på blodsockernivån under och efter hypoglykemi (20)
Sammanfattning:
- Hypoglykemi är vanligt, farligt, samt skapar ångest och oro
- Ca 20% drabbas årligen av minst ett allvarligt tillbud (tillbud där patenten kräver hjälp av utomstående).
- Ca 4% drabbas av upprepade allvarliga tillbud , många av dessa har defekt förmåga att stegra adrenalin vid hypoglykemi.
- Glukagon och adrenalin deltar i den akuta motregulationen av hypoglykemi
- Effektiv motregulation kan ske utan medverkan av glukagon förutsatt att förmågan att frisätta adrenalin är intakt.
- Tillväxthormon och adrenalin ger upphov till insulinresistens under 6-8 timmar efter hypoglykemi, men storleken av den stegring av p-glukos som därvid uppstår är vanligtvis modest, ca 5 mmol/l.
- Lång sjukdomsduration och lågt HbA1c ökar risken för allvarliga tillbud
- Intraperitoneal insulin tillförsel ger, lägre systemisk insulinemi, bättre reproducerbarhet v.g. cirkulerade insulinnivå efter bolusdos och mindre risk för hypoglykemi. Förutsatt att teknikutvecklingen förbättras förefaller intraperitoneal överlägsen subcutan insulintillförsel.
Tack till mina medarbetare:
Alexander Wajngot, Anders Björklund, AnnChristin Salomonsson, Bertil Hamberger,
Bo Ahren, Erik Moberg, Dating Liu, Gun Jörneskog, Joakim Bragd, Kerstin Bergqvist, Lars Backman, Lena Gabrielsson, Lena Hannerz, Lena Landstedt-Hallin, Magnus Kollind, Marie Guldstrand,
Nina Clausen-Sjöbom, Per-Eric Lins, Per Oskarsson, Regina Wredling, Renee Lidbom Hedin,
Suad Efendic, Susanne Amsberg, Sofia, Sten Levander, Tore Curstedt, Therese Anderbro,
UnnBritt Johansson, Valdemar Grill, Åsa Nybäck-Nakell
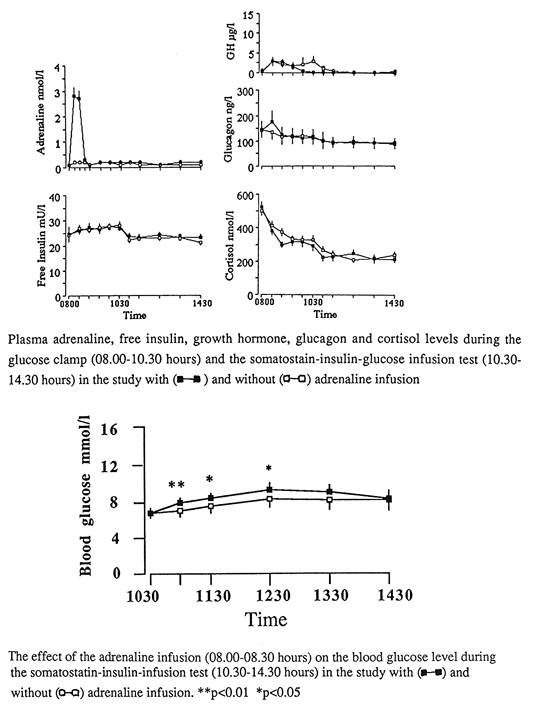
Bild 26. Effekt av adrenalin infusion under 30 min (till samma nivå som uppnås under hypoglykemi) på insulinkänsligheten (17).

Bild 27. Medicinsk bildgåta! (26)
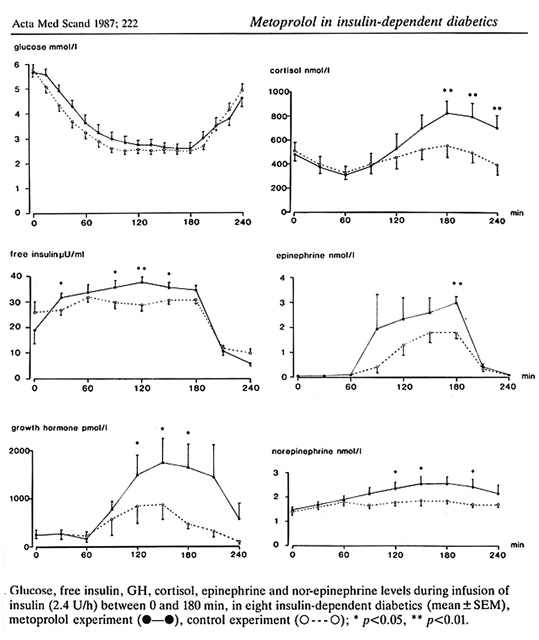
Bild 28. Effekt av metoprolol på blodsockernivå och motregulation under och efter hypoglykemi utlöst med insulininfusion (13)
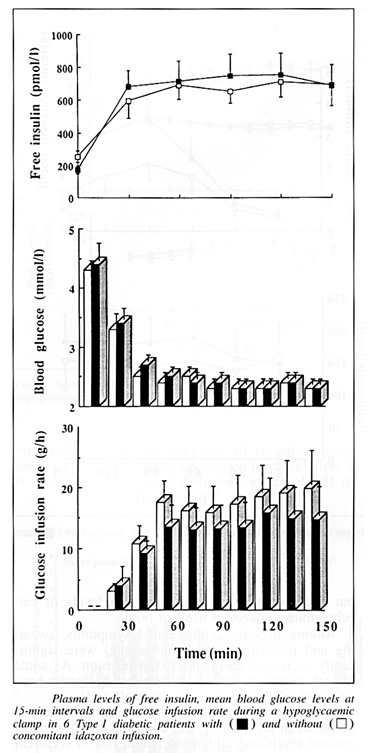
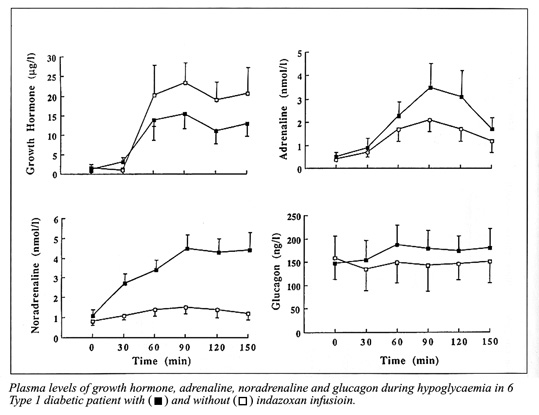
Bild 29. Effekt av idazoxan på blodsockernivån, infusionshastighet av glukos och hormonell motregulation under hypoglykemisk clamp (38).
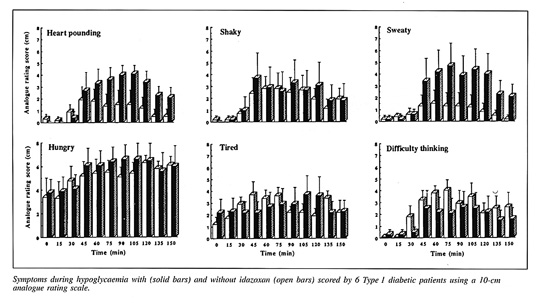
Bild 30. Effekt av idazoxan på hypoglykemiska symptom (38).
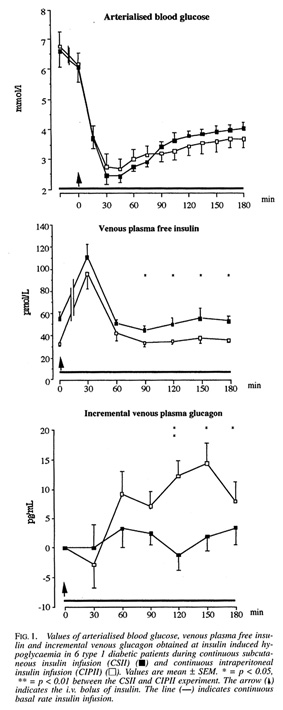
Bild 31. Blodsockerprofil, insulin och glukagonnivåer under hypoglykemi utlöst via insulininfusion s.c. respektive i.p. (48)
Referenslista
1. Grill V, Adamson U, Rundfeldt M, Andersson S, Cerasi E. The glucose memory of pancreatic B- and A-cells. J Clin Invest 64:700-707, 1979.
2. Adamson U, Grill V, Efendic S. Previous exposure to glucose enhances insulin and suppresses glucagon response to arginine in man. Acta Diabet Lat 18:173-179, 1981.
3. Adamson U. On the diabetogenic effect of growth hormone in man: Effects of growth hormone on glucagon and insulin secretion. Europ J Clin Invest 11:115-119, 1981.
4. Adamson U, Efendic S, Lins PE, Wajngot A. Effect of somatostatin on insulin-induced hypoglycaemia in man. Acta Med Scand 212:33-37, 1982.
5. Lins PE, Wajngot A, Adamson U, Vranic M, Efendic S. Minimal increases in glucagon levels enhance glucose production in man with partial hypoinsulinemia. Diabetes 32:633-636, 1983.
6. Adamson U, Lins PE, Efendic S, Hamberger B, Wajngot A. Impaired counter-regulation of hypoglycaemia in a group of insulin dependent diabetics with recurrent episodes of severe hypoglycaemia. Acta Med Scand 216:215-222, 1984.
7. Lins PE, Clausen N, Adamson U, Kollind M, Hamberger B, Efendic S. Effect of improved glycemic control by continuos subcutaneous insulin infusion on hormonal responses to insulin induced hypoglycaemia in type I diabetics. Acta Med Scand 218:111-118, 1985.
8. Adamson U, Lins PE. Hormonell motregulation av hypoglykemi hos insulinbehandlade diabetiker. Läkartidningen 40:3369-3370, 1985.
9. Lins PE, Adamson U, Clausen N, Hamberger B, Efendic S. The role of glucagon, catecholamines and cortisol in counter-regulation of insulin-induced hypoglycaemia in normal man. Acta Med Scand 220:39-46, 1986.
10. Clausen N, Lins PE, Adamson U, Hamberger B, Efendic S. Counterregulation of insulin-induced hypoglycaemia in primary hypothyroidism. Acta Endocr (Kbh) 111:516-521, 1986.
11. Kollind M, Adamson U, Lins PE, Efendic S: Insulin resistance after acute administration of GH and ACTH in insulin-dependent diabetes mellitus. Horm Met Res 19:156-159, 1987.
12. Clausen-Sjöbom N, Adamson U, Lins PE. Preexposure to glucagon impairs glucose recovery after insulin-induced hypoglycaemia in normal man. Horm Met Res 19:375-378, 1987.
13. Clausen-Sjöbom N, Lins PE, Adamson U, Curstedt T, Hamberger B. Effects of metoprolol on the counter-regulation and recognition of prolonged hypoglycaemia in insulin dependent diabetics. Acta Med Scand 222:57-63, 1987.
14. Fourest-Fontecave S, Adamson U, Lins PE, Ekblom B, Sandahl C, Strand L. Mental alertness in response to hypoglycaemia in normal man: The effect of 72 hours of fasting. Diab & Metab (Paris) 13:405-410, 1987.
15. Adamson U, Lins PE, Fourest-Fontecave S, Grill V. Counterregulation of hypoglycaemia after overnight and 72 hours of fasting.In Hypoglycaemia (eds. Andreani D, Marks V, Lefebvre PJ) Serono Symposia Publications Volume 38, Raven Press, New York, pp 289-290, 1987.
16. Kollind M, Adamson U, Lins PE. Insulin resistance following nocturnal hypoglycaemia in insulin-dependent diabetes mellitus. Acta Endocr (Kbh) 116:314-320, 1987.
17. Kollind M, Adamson U, Lins PE, Hamberger B. Transient insulin resistance following short-term infusion of adrenaline in insulin-dependent diabetes mellitus. Diabetologia. 31:603-606, 1988.
18, Kollind M, Adamson U, Lins PE. Importance of growth hormone for blood glucose regulation following insulin-induced hypoglycaemia in insulin-dependent diabetes mellitus. Acta Med Scand 223:159-64, 1988
19. Kollind M, Adamson U, Lins PE. Studies on insulin-resistance following hypoglycaemia in insulin-dependent diabetes mellitus. Acta Med Scand 223:153-7, 1988.
20. Kollind M, Adamson U, Lins PE. Somatostatin reduces post-hypoglycaemic insulin resistance in insulin-dependent diabetes mellitus. Acta Endocr (Kbh) 118:173-78, 1988.
21. Adamson U, Lins PE, Grill V. Fasting for 72 h decreases the responses of counter-regulatory hormones to insulin-induced hypoglycaemia in normal man. Scand J Clin Lab Invest 49:751-6, 1989.
22. Clausen-Sjöbom N, Adamson U, Lins PE. The prevalence of impaired glucose counter-regulation during an insulin infusion test in insulin-treated diabetic patients. Diabetologia 32: 818-25, 1989.
23. Wredling R, Lins PE, Adamson U. Prevalence of anti-insulin antibodies and its relation to severe hypoglycaemia in insulin treated diabetic patients. Scand J Clin Lab Invest, 50:551-7, 1990.
24. Wredling R, Levander S, Adamson U, Lins PE. Permanent neuropsychological impairment after recurrent episodes of severe hypoglycaemia. Diabetologia 33:152-7, 1990.
25. Clausen-Sjöbom N, Lins PE, Adamson U, Theodorsson E. A comparative study on the hormonal responses to insulin-induced hypoglycaemia using semisynthetic human insulin and pork insulin in patients with insulin dependent diabetes mellitus. Diabetic medicine 7:775-9, 1990.
26. Kollind M, Adamson U, Lins PE. Michael Somogyi och blodsockerrekyl vid instabil diabetes; Kontroversiell hypotes som fortfarande diskuteras (i serien: ”Mannen bakom syndromet”). Läkartidningen 88: 878-9, 1991.
27. Kollind M, Moberg E, Liu D, Lins PE, Adamson U. Insulin clearance during hypoglycaemia in patients with insulin-dependent diabetes mellitus. Horm Med Res 23: 333-5, 1991.
28. Wredling R, Adamson U, Lins PE, Backman L, Lundgren D. Experiences of long-term intraperietoneal insulin treatment using a new percutaneous device. Diabetic Med 8:597-600, 1991.
29. Wredling R, Liu D, Lins PE, Adamson U. Variation of insulin absorption during subcutaneous and peritoneal infusion in insulin-dependent diabetic patients with unsatisfactory long-term glycemic response to continuous subcutaneous insulin infusion. Diabete et Metabolism 17:456-9, 1991.
30. Liu D, Moberg E, Kollind M, Lins PE, Adamson U. A high concentration of circulating insulin suppresses the glucagon response to hypoglycaemia in normal man. J Clin Endocr Metab 73 (5):1123-8, 1991.
31. Liu D, Moberg E, Kollind M, Lins PE, Adamson U. Inhibitory effect of circulating insulin on glucagon secretion during hypoglycaemia in type 1 diabetic patients. Diabetes Care 15 (1):59-65, 1992.
32. Wredling R, Theorell T, Roll M, Lins PE, Adamson U. Psychosocial state of patients with insulin-dependent diabetes mellitus prone to recurrent episodes of severe hypoglycaemia. Diabetes Care 15 (4): 518-21, 1992.
33. Liu D, Moberg E, Kollind M, Lins PE, Adamson U, Macdonald I. Arterial, arterialized venous, venous, and capillary blood glucose measurements in normal man during hyper-insulinaemic euglycaemia and hypoglycaemia. Diabetologia 39 (3):287-90, 1992.
34. Liu, D Andréasson K, Lins PE, Adamson U, Macdonald I. Adrenaline and noradrenaline responses during insulin-induced hypoglycaemia in man: should the hormone levels be measured in arterialized venous blood? Acta Endocrinol 128:95-8, 1993.
35. Liu D, Adamson U, Lins PE, Clausen-Sjöbom N. An analysis of the glucagon response to hypoglycaemia in patients with type I diabetes and in healthy subjects. Diabetic Medicine 10:245-54, 1993.
36. Jörneskog G, Lins P-E, Adamson U, Fagrell B. Patients with type I diabetes lack vasocontrictor response in skin microcirculation during insulin-induced hypoglycaemia. Int J Microcirc 14: 262-8, 1994.
37. Moberg EAR, Lins P-E S, Adamson U K C; Variability of blood glucose levels in patients with type I diabetes on intensified insulin regimens. Diabete et Metabolisme 20:546-552, 1994.
38. Moberg EAR, Kollind ME, Östensson C-G, Lins PE, Adamson U. The alpha-adrenoreceptor antagonist idazoxan reduces growth hormone and increases glucagon and catecholamine responses to hypoglycaemia in patients with insulin-dependent diabetes mellitus. Diabéte et Metabolisme 22:31-6, 1996.
39. Björklund A, Adamson U, Almström H, Enocksson E, Gennser GM, Lins PE, Westgren M. Effect of hypoglycemia on fetal heart activity and umbilical artery Doppler velocity waveform in pregnant women with insulin-dependent diabetes mellitus. Brit J Obstr and Gynecol 103: 413-20, 1996.
40. Oskarsson P, Johansson B-L, Adamson U, Lins PE. Effect of C-peptide on insulin-induced hypoglycemia and its counterregulatory responses in IDDM patients. Diabetic Medicine 14:655-9, 1997.
41. Björklund A, Adamson U, Andreasson K, Carlström A, Hennen G, Igout A, Lins PE, Westgren M. Hormonal counterregulation and subjective symptoms during induced hypoglycemia in insulin-dependent diabetes mellitus patients during and after pregnancy. Acta Obstet Gynecol Scand 77:625-34, 1998.
42. Björklund A, Adamson U, Carlström A, Hennen G, Igout A, Lins P-E, Westgren M: Placental hormones during induced hypoglycemia in pregnant women with insulin-dependent diabetes mellitus. Evidence of an active role for placenta in hormonal counterregulation. British J.Ob and Gyn 105:649-55, 1998.
43. Björklund A, Adamson U, Lins PE, Westgren M; Diminished insulin clearance during late pregnancy in patients with type 1 diabetes mellitus. Clinical Science 95:317-23, 1998.
44. Oskarsson P, Clausen N, Adamson U, Lins PE. Ten year follow-up of IDDM patients with recurrent episodes of severe hypoglycemia. Diabetes Research and Clinical Practice 44:165-74, 1999.
45. Landstedt-Hallin L, Adamson U, Lins PE. oral glibenclamide suppresses glucagon secretion during insulin-induced hypoglycemia in patients with type 2 diabetes. J Clin Endocrinol Metab 84:3140-5, 1999.
46. Landstedt-Hallin L, Englund A, Adamson U, Lins PE. Increadsed QT dispersion during hypoglycemia in patients with type 2 diabetes mellitus. J Intern Med 246:299-307, 1999.
47. Oskarsson P, Lins PE, Wallberg-Henriksson H, Adamson UC: Metabolic and hormonal responses to exercise in type 1 diabetic patients during continuous subcutaneous, as compared to continuous intraperitoneal, insulin infusion. Diabetes & Metabolism (Paris) 25:491-7, 1999.
48. Oskarsson P, Lins PE, Ahrén B, Adamson U. Circulating insulin inhibits glucagon secretion induced by arginine in type 1 diabetes. Europ J Endocr 142:30-4, 2000.
49. Oskarsson PR, Lins PE, Backman L, Adamson U. Continuous intraperitoneal insulin infusion partly restores the glucagon response to hypoglycemia in type 1 diabetic patients. Diabetes metab 26:118-24, 2000.
50. Adamson U, Lins PE; Subcutaneous Insulin Pump Therapy in Sweden. Infusystems International 1, 2 10-13, 2002.
51. Bragd J, Adamson U, Lins PE, Wredling R, Oskasson P. A repeated cross sectional survey of severe hypoglycaemia in 178 type 1 DM patients performed in 1984 and 1998. Diabetic Med, 20:216-9, 2003.
52. Guldstrand M, Ahrén B, Wredling R, Backman L, Lins PE, Adamson U. Alteration of the counterregulatory responses to insulin-induced hypoglycemia and of cognitive function after massive weight reduction in severely obeses subjects. Metabolism 52:7: 900-7, 2003.
53. Bragd J, Oskarsson P, Adamson U, Lins PE. Tillbud av allvarlig hypoglykemi – ökande problem vid diabetes typ 1, Läkartidningen 51-52 (101):4202-5, 2004.
54. Gudbjörnsdottir S, Cederholm J, Nilsson P, Eliasson B, Berne C, Adamson U. Nationella diabetesregistret 1996-2003 – Kvalitetsvärdering visar att diabetsvården har förbättrats. Läkartidningen 47 (101):3790-7, 2004.
55. Nybäck-Nakell Å, von Heine M, Adamson U, Lins PE, Landstedt-Hallin L, Accuracy of continuous nocturnal glucose monitoring after 48 and 72 hours in type 2 diabetes patients on combined oral and insulin therapy. Diabetes Metab 30, 517-21, 2004.
56. Clausen Sjöbom N. Hormoneal counterregulation of prolonged hypoglycemia induced by insulin in diabetes mellitus and hypothyroidism. Thesis. Karolinska Institutet Stockholm 1989.
57. Wredling R. On the management of insulin-dependent diabetes mellitus. Thesis. Karolinska Institutet Stockholm 1991.
58. Oskarsson P. Studies on glucagon secretion in patients with type 1 diabetes. Thesis. Karolinska Institutet Stockholm 1999 sida 41-44.
59. Can glycaemic variability, as calculated from self-monitoring of blood glucose, predict the development of complications in Type 1 diabetes over a decade? Bragd J, Adamson U, Bäcklund LB, Lins PE, Moberg E and Oskarsson P. Diabetes & Metab 34, 612-6, 2008.
60. Fear of hypoglycaemia in adults with type 1 diabetes and its relation to demographic and disease specific factors .Anderbro T, Amsberg S, Adamson U, Bolinder J, Lins P-E, Wredling R, Moberg E, Lisspers J, Johansson U-B. Abstract IDF congress, Montreal Canada, 2009.
|Upp|
