
Gå tillbaka
Motion som prevention och
behandling av typ 2 diabetes
Claes-Göran Östenson,
Peter Båvenholm och Suad Efendic,
Karolinska sjukhuset, Stockholm.
Typ 2 diabetes kännetecknas av såväl kronisk hyperglykemi
som andra metabola rubbningar i bland annat lipidomsättning och hemostas.
Hyperglykemin utvecklas oftast på grund av nedsatt insulinkänslighet
(insulinresistens) och minskad en otillräcklig insulinsekretion [1,2]som
inte förmår bibehålla en normal blodglukosnivå.
Insulinresistens förekommer både i levern och extrahepatiska
vävnader, främst skelettmuskulaturen och fettväven. Detta
leder till ett ökad lipolys som bidrar till ökad glukosproduktion
i levern och minskat glukosupptag i musklerna. Typ 2 diabetes utvecklas
när ß-cellen inte kan producera tillräckligt med insulin
för att kompensera för insulinresistensen. Sjukdomen utvecklas
hos genetiskt predisponerade individer via förstadier som förhöjt
fasteglukos (impaired fasting glucose, IFG) och nedsatt glukostolerans
(impaired glucose tolerance; IGT). Ärftligheten anses vara polygen
hos de flesta diabetiker, men vilka gener som ansvarar för defekter
i insulinsekretionen, insulinkänsligheten och eventuellt andra metabola
rubbningar är ännu enbart delvis belyst.
Prevalensen av typ 2 diabetes ökar kraftigt globalt och går
i vissa länder även ner i åldrarna på ett tidigare
aldrig skådat sätt [3]. Till dags dato förefaller utvecklingen
i Sverige inte vara lika dramatisk och 3-4 % av den totala befolkningen
beräknas ha sjukdomen [4]. Inte desto mindre har nyligen beräknats
att 6-7 % av de svenska kostnaderna för hälso- och sjukvård
går till typ 2 diabetes, främst till behandling av makro- och
mikroangiopatiska komplikationer [5]. Mot denna bakgrund framstår
primär prevention av typ 2 diabetes som allt mer angeläget.
De flesta faktorer som är kända för att öka risken
för typ 2 diabetes minskar insulinkänsligheten. Hit hör
sålunda övervikt, fysisk inaktivitet, låg födelsevikt,
tobaksbruk, psykosocial stress, samt vissa läkemedel och sjukdomar
[6]. Omvänt kan försök att minska förekomst av dessa
risktillstånd användas i syfte att förebygga, fördröja
eller behandla sjukdomen.
Fysisk träning som prevention av typ 2 diabetes
Under de senaste decennierna har en rad prospektiva studier av stora grupper
friska individer understrukit betydelsen av fysisk aktivitet för
att förbygga typ 2 diabetes. Uppföljning i USA av drygt 87.000
kvinnor och 21.000 män i medelåldern under en period av fem
till åtta år, visade att de som motionerade relativt kraftigt
minst en gång om 30 minuter per vecka, minskade den relativa diabetesrisken
med 35 % [7,8]. Även senare prospektiva uppföljningar har visat
signifikant reduktion av diabetesrisken genom motion av måttlig
intensitet och duration [9-11]. I en studie av knappt 6.000 manliga amerikanska
studenter påvisades att incidensen av typ 2 diabetes under 14 års
uppföljning minskade med ökat energiutnyttjande genom motion
på fritiden [12]. I denna relativt unga grupp medförde en energiförbrukning
motsvarande 2000 kcal per vecka att den relativa diabetesrisken minskade
med 24 %. Den skyddande effekten var starkast hos män med diabetes
i släkten [12]. Även en mindre studie gjord på Malta redovisade
under en tvåårsperiod nära tre gånger ökad
risk för IGT hos individer med låg fysisk aktivitet jämfört
med dem som motionerade regelbundet [13].
De mest avgörande bevisen för att fysisk aktivitet spelar en
viktig roll i preventionen av typ 2 diabetes har erhållits i flera
studier, där interventionen riktats till individer med hög diabetesrisk,
dvs personer med IGT. Signifikant positiva effekter påvisades i
en kinesisk studie i staden DaQing, där 577 individer med nedsatt
glukostolerans fördelades till fyra grupper: intervention enbart
med kost, enbart fysisk aktivitet, kombination av kost och fysisk aktivitet
samt en kontrollgrupp [14]. Efter sex år hade typ 2 diabetes diagnosticerats
hos 68 % i kontrollgruppen, mot endast 44 % i kostgruppen, 41 % i motionsgruppen
och 46 % i gruppen med både kost- och motionsintervention. I en
annan icke-randomiserad studie i Malmö av personer med IGT, minskade
kombinationen av kostråd och regelbunden motion under sex års
tid risken för typ 2 diabetes till 11 % i interventionsgruppen jämfört
med 21 % i en kontrollgrupp [15].
Slutligen har under 2000-talets början två kontrollerade och
randomiserade studier presenterat övertygande evidens för den
potenta diabetespreventiva effekten av livsstilsförändring omfattande
regelbunden fysisk aktivitet, koständring och viss viktsminskning.
I den finska Diabetes Prevention Study (DPS) randomiserades 522 män
och kvinnor med IGT, medelålder 55 år och medel-BMI 31 kg/m2,
till interventionsgrupp eller kontrollgrupp [16]. Interventionens mål
bestod i att minska minst 5 kg i vikt, äta en mat innehållande
högst 30 E% fett varav högst 10 E% mättat fett och med
åtminstone 15 g fiber per 1000 kcal, samt motionera i måttlig
takt minst 30 min dagligen. Deltagarna stöddes genom regelbundna
kontakter med nutritionist, sju gånger under det första året
och därefter var tredje månad. Förutom kostråd uppmuntrades
deltagarna att ägna sig åt att promenera, jogga, simma, åka
skidor eller cirkelträning. Oralt glukostoleranstest genomfördes
vid studiestarten och därefter årligen. Studien visade att
viktminskningen jämfört med utgångsvikten hos deltagarna
i interventionsgruppen var 4,2 kg, 3,5 kg och 3,5 kg efter 1, 2 respektive
3 år. Motsvarande viktminskning i kontrollgruppen var 0,8 kg, 0,8
kg respektive 0,9 kg. Den kumulativa incidensen av typ 2 diabetes efter
fyra år var 11 % i interventionsgruppen och 23 % i kontrollgruppen.
Den relativa diabetesrisken minskade således med 58 %.
Samma år som den finska DPS publicerades avbröts den större
amerikanska studien Diabetes Prevention Program (DPP) förtida efter
knappt tre års tid, eftersom interimsanalys visade övertygande
och positiva resultat [17]. I denna studie ingick ursprungligen fyra behandlingsgrupper
med personer med IGT vid 27 centra i USA: Troglitazon, metformin (850mgx2),
livsstilsförändring och placebo. Till vardera gruppen randomiserades
drygt 1000 personer med medelålder 51 år och BMI 34 kg/m2.
Uppföljningen skedde med en medeltid av nästan tre år.
På grund av biverkningar avbröts troglitazon-armen efter ca
ett år. Livsstilsinterventionen innebar mer omfattande insatser
än i DPS, med kurser om mat och motion samt månatliga träffar
med nutritionister och fysioterapeuter både individuellt och i grupp.
Målet för livsstilsinterventionen var att uppnå och behålla
en viktminskning på åtminstone 7 % genom att äta en mat
med lågt innehåll av kalorier och fett samt motionera, t ex
snabb promenad, minst 150 minuter per vecka. Viktminskningen nådde
ca 7 % efter ett halvår i livsstilsgruppen, men planade ut på
ca 4% mot slutet av studietiden. Viktminskningen i metformingruppen var
mera blygsam, ca 2 %, och uteblev helt i placebogruppen. I livsstilsgruppen
uppnådde 74 % motionsmålet efter ett halvår medan 58
% gjorde det vid studiens slut. Den årliga incidensen av typ 2 diabetes
var 11 %, 7,8 % respektive 4,8 % i placebo-, metformin- och livsstilsgrupperna.
Liksom i DPS reducerades den relativa risken att utveckla diabetes med
58 % genom livsstilsintervention. Motsvarande effekt i metformingruppen
var 31 %. Sammantaget är det således övertygande visat
att fysisk aktivitet, ensamt eller kombinerat med kostintervention, minskar
riskenför att utveckla typ 2 diabetes.
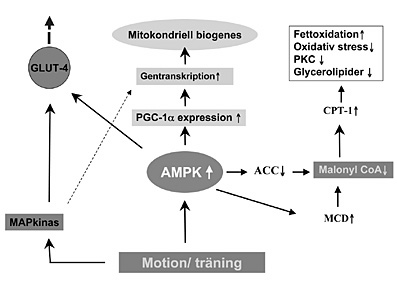
Figur. Mekanismer bakom ökat glukosupptag och förbättrad insulinkänslighet efter fysisk träning. Muskelarbete aktiverar AMPK, vilket leder till en hämning av ACC och en aktivering av MCD. Detta resulterar i sin tur i sänkta nivåer av malonyl CoA i muskelcellernas cytosol. Den mitokondriella fettoxidationen ökar till följd av en minskad inhibition av enzymet CPT1. AMPK ökar också mitokondriell biogenes via en uppreglering av PGC1- och de gener som styr oxidativ fosforylering. Både AMPK och p38 MAP kinas stimulerar glukosupptaget genom att öka expressionen och translokationen av GLUT4. MAP kinaserna är direkt involverade i genregleringen.
Fysisk träning vid typ 2 diabetes - effekter på insulinkänslighet,
glukostolerans och HbA1c
I vilken grad minskar motion insulinresistensen och påverkar den
metabola kontrollen hos patienter med manifest typ 2 diabetes? Det är
klart visat från ett flertal studier att långvarig fysisk
träning förbättrar insulinkänsligheten, mätt
med euglykemisk-hyperinsulinemisk klampteknik ("golden standard"),
hos typ 2 diabetiker. Effekten på insulinkänslighet är
uttalad efter 6-12 veckors regelbunden träning med en intensitet
som motsvarar 50-60% av maximalt syrgasupptag (V02 max) 1 tim 3-7 ggr/vecka
[18,19]. Effekten av fysisk träning på fasteglukosnivån
och glukostoleransen (OGTT; oralt glukostoleranstest) varierar [18-20].
I en studie fann man att glukostoleransen var förbättrad upp
till 17 timmar efter att träningen upphört, men ej efter 3 dagar
[21], och andra har visat förbättrad OGTT med lägre [22]
eller oförändrade [23] plasma insulinnivåer. I de studier
där man kunde påvisa en positiv effekt på OGTT genomfördes
hårdare träningsprogram, cykling eller jogging motsvarande
80-85 % av V02 max 3-4 ggr/vecka under 3-12 månader [22,23]. Diskrepansen
mellan olika studier kan bero på skillnader i frekvens, duration
och intensitet av träningen. Det har också betydelse vilken
specifik diabetes population man studerar, och om träning kombinerats
med en kalorirestriktiv kostregim. Den metabola kontrollen förbättras
vanligtvis vid långvarig träning, och minskningen av HbA1c
är mest uttalad (10-20%) hos patienter med mild diabetes och med
uttalad insulinresistens. Denna patientgrupp är mer hyperinsulinemisk
jämfört med patienter som har en mer uttalad hyperglycemi [24].
Efter 6 veckors måttligt intensiv träning sjönk HbA1c
nivåerna med 15 % [19,21]. Det är ovedersägligt att muskelaktivitet
hos diabetespatienter hjälper till att sänka blodglukosnivån.
De bakomliggande mekanismer som reglerar glukosupptaget vid akut muskelarbete
överlappar endast delvis med mekanismer som medierar förbättrat
glukosupptag och insulinkänslighet i samband med långvarig
fysisk träning.
Mekanismer för ökad glukosupptag och förbättrad
insulinkänslighet vid akut muskelarbete
Akut muskelarbete ökar glykogenolysen, vilket får till följd
att omedelbart efter arbete ökar glukosupptag och glykogensyntes
i musklerna kompensatoriskt genom ökad aktivitet hos glykogensyntas
[25]. Det har föreslagits att låga glykogendepåer i sig
resulterar i en ökad cytosolisk pool av glukostransportörer,
GLUT-4, som möjliggör intransporten av glukos in i cellen [26].
Vid akut muskelarbete ökar också translokeringen av GLUT-4
till cellmembranet via en insulin-oberoende mekanism [27,28]. Ett flertal
arbeten tyder på att denna process är relaterad till aktivering
av intracellulär signalering genom MAP-kinas (mitogen-activated kinase),
men även resultatet av en akut aktivering av AMP-aktiverat proteinkinas
(AMPK). De MAP-kinaser man fokuserat på är extracellulärt
signalreglerat kinas (ERK), C-Jun NH2-terminal kinas (JNK) och p38-signaleringskaskaden.
Aktiverade MAP-kinaser translokerar till cellkärnan och reglerar
där transkriptionen av ett flertal gener. Av specifikt intresse är
p38 MAP-kinas, eftersom man visat att p38 deltar i kontraktions-stimulerat
glukosupptag i skelettmuskulaturen samt är involverat i regleringen
av glukostransporten.
Fysisk aktivitet minskar glykogendepåerna och ökar de intracellulära
kvoterna av AMP/ATP och kreatin/fosfokreatin, vilket aktiverar AMPK. Glukosmetabolismen
stimuleras samtidigt genom att AMPK ökar aktiviteten av fosfofruktokinas-2
(PFK-2) och därmed flödet genom glykolysen [29]. Aktiverat AMPK
leder till en minskad aktivitet av acetyl CoA karboxylas (ACC), det enzym
som reglerar syntesen av malonyl CoA. Samtidigt ökar aktiviteten
av malonyl CoA dekarboxylas (MCD), som är det enzym som degraderar
malonyl CoA till acetyl CoA. Minskade nivåer av malonyl CoA leder
till en ökad aktivitet av enzymet carnitine palmitoyltransferase
(CPT1) (Figur), och därmed en ökad transport av långa
fettsyror in i mitokondrier där dessa oxideras. Fysisk aktivitet
korrigerar således en grundläggande defekt vid insulinresistens,
dvs en ökning av malonyl CoA vilket minskar fettoxidationen och faciliterar
en ansamling av av långa fettsyror (LCFA CoA; long chain fatty acyl
CoA) och diacylglycerol (DAG) i cytosolen. En ansamling av glycerolipider
i cytosolen leder till en aktivering av PKC (proteinkinas C) isoenzymer,
ökad syntes av ceramide och ökad aktivering av NFB-systemet,
samt oxidativ stress och mitokondriell dysfunktion. Sammantaget resulterar
detta bl a i försämrad insulinkänslighet [30].
Mekanismer för ökat glukosupptag och förbättrad
insulinkänslighet vid långvarig fysisk träning
Per Björntorps grupp rapporterade 1972 att glukostoleransen var bättre
och plasmainsulinnivåerna lägre hos vältränade personer
i jämförelse med en kontrollpopulation [31]. Inte förrän
1987 visade man att akut fysisk träning ökar insulin-medierat
glukosutnyttjande även hos patienter med typ 2 diabetes [32]. Hög
insulinkänslighet hos tränade individer minskar inom 2-3 dagar
om träningen upphör. Beträffande mekanismen bakom en ökad
insulinkänslighet efter träning gjordes ett genombrott när
man påvisade en ökad translokation av GLUT-4 från en
intracellulär lokalisation till cellmembranet genom en distinkt mekanism
[33]. Idag finns starka belägg för att det finns separata pooler
av GLUT-4 som mobiliseras vid fysik träning [34]. Det är också
visat att långvarig träning ökar expressionen av GLUT-4
både på protein- och mRNA-nivå [35].
AMPK har en central betydelse för translokeringen av GLUT-4 vid fysisk
träning. Detta illustreras i försök där en aktivator
av AMPK, AICAR, ökar glukosupptaget via en ökad GLUT-4 expression
och translokation [36]. Denna effekt involverar inte tidiga eller intermediära
steg i insulinsignaleringen. Således faciliterar aktiveringen av
AMPK, genom farmakologiska substanser eller träning, insulin-medierat
glukosupptag oberoende av PI3-kinas [37]. I detta sammanhang är det
intressant att ökningen av AMPK-aktivitet är transient och varar
15-90 minuter efter avslutat muskelarbete [38]. Aktivering av AMPK vid
fysisk träning har dock en rad andra effekter av betydelse för
muskelns adaptation vid fysisk träning. Som tidigare diskuterats
minskar nivåerna av malonyl CoA i muskel, vilket leder till en förbättrad
fettoxidation och en minskad oxidativ stress och därmed förbättrad
insulinkänslighet (se Figur). Nyligen är det visat att AMPK
är essentiell för mitokondriell biogenes och anpassning av muskelns
oxidativa kapacitet till träning [39]. Denna effekt är troligen
medierad via en uppreglering av calcium/calmodulin-beroende proteinkinas-IV
(CaMK-IV) och peroxisom proliferation-aktiverad receptor gamma coactivator-1
(PGC-1), två nyckelfaktorer för reglering av mitokondriell
biogenes. I detta sammanhang är det också av stort intresse
att CaMK-IV och PGC-1 har viktiga roller vid långvarig träning,
genom att inducera transformering från snabba till långsamma,
mer insulinkänsliga muskelfibrer [40].
Nyligen har man visat att insulinresistens vid typ 2 diabetes är
associerad med nedreglering av gener som är involverade i reglering
av mitokondriell funktion, dvs oxidativa fosforyleringen [41,42]. Dessa
rubbningar hänförs till en nedreglering av PGC-1. Mot bakgrund
av att det nyligen föreslagits att insulinresistens beror på
en nedärvd mitokondriell dysfunktion [43], är det av stor betydelse
att undersöka huruvida dessa mitokondriella defekter är reversibla
med träning eller inte. Långvarig fysisk träning påverkar
också insulinkänsligheten genom att modulera kroppskonstitutionen
(öka muskelmassa, minska central bukfetma), öka hepatisk insulinkänslighet,
och förbättra lipidmetabolismen [44].
Sammanfattning
Stora randomiserade, prospektiva studier visar att regelbunden, måttlig
fysisk träning minskar risken för individer med IGT att insjukna
i typ 2 diabetes. Starkt stöd finns för att fysisk träning
förbättrar metabol kontroll hos typ 2 diabetiker. Vid akut muskelarbete
ökar glukosupptaget. Därtill leder fysisk träning till
en ökad insulinkänslighet hos typ 2 diabetiker via multipla
metabola och transkriptionella adaptationsmekanismer. Dessa inkluderar
bl.a. förändringar i GLUT4 protein, förbättrad enzymkapacitet,
ökad kapillarisering och ökad gentranskription. Det behövs
stora insatser för att implementera strategier som syftar till att
öka graden av fysisk träning inom befolkningen, speciellt så
hos individer med IGT och typ 2 diabetes. Det finns alla skäl att
anta att dessa åtgärder leder till stora besparingar för
samhället, och bättre hälsa och livskvalité hos
befolkningen.
Referenser
1. Östenson CG. The pathophysiology of type 2 diabetes mellitus:
an overview. Acta Physiol Scand 2001;171:241-247.
2. Gerich JE. The genetic basis of type 2 diabetes mellitus: impaired
insulin secretion versus impaired insulin sensitivity. Endocr Rev 1998;19:491-503.
3. King H, Aubert RE, Herman WH. Global burden of diabetes, 1995-2025:
prevalence, numerical estimates, and projections. Diabets Care 1998;21:1414-1431.
4. Eliasson M, Lindahl B, Lundberg V, Stegmayr B. No increase in the prevalence
of known diabetes between 1986 and 1999 in subjects 25-64 years of age
in northern Sweden. Diab Med 2002;19:874-880.
5. Henriksson F, Agardh CD, Berne C, Bolinder J, Lönnqvist F, Stenström
P, et al. Direct medical costs for patients with type 2 diabetes in Sweden.
J Intern Med 2000;248:387-396.
6. Hamman RF. Genetic and environmental determinants of non-insulin-dependent
diabetes mellitus (NIDDM). Diabetes Metab Rev 1992;8:287-338.
7. Manson JE, Rimm EB, Stampfer MJ. Physical activity and incidence of
non-insulin-dependent diabetes mellitus in women. Lancet 1991;338:774-778.
8. Manson JE, Nathan DM, Krolewski AS, Stampfer MJ, Willett WC, Hennekens
CH. A prospective study of exercise and incidence of diabetes among US
male physicians. JAMA 1992;268:63-67.
9. Hu FB, Sigal RJ, Rich-Edwards JW, Colditz GA, Solomon CG, Willett WC,
et al. Walking compared with vigorous physical activity and risk of type
2 diabetes in women: a prospective study. JAMA 1999;282:1433-1439.
10. Okada K, Hayashi T, Tsumura K, Suematsu C, Endo G, Fujii S. Leisure-time
physical activity at weekends and the risk of Type 2 diabetes mellitus
in Japanese men: the Osaka Health Survey. Diab Med 2000;17:53-58.
11. Folsom AR, Kushi LH, Hong CP. Physical activity and incident diabetes
mellitus in postmenopausal women. Am J Public Health 2000;90:134-138.
12. Helmrich SP, Ragland DR, Paffenbarger RS Jr. Prevention of non-insulin-dependent
diabetes mellitus with physical activity. Med Sci Sports Exerc 1994;26:824-830.
13. Schranz A, Tuomilehto J, Marti B, Jarrett RJ, Grabauskas V, Vasallo
A. Low physical activity and worsening of glucose tolerance: results from
a 2-year follow-up of a population sample in Malta. Diabetes Res Clin
Pract 1991;11:127-136.
14. Pan XR, Li GW, Hu YH, Wang JX, Yang WY, An ZX, et al. Effects of diet
and exercise in preventing NIDDM in people with impaired glucose tolerance.
The Da Qing IGT and Diabetes Study. Diabetes Care 1997;20:537-544.
15. Eriksson KF, Lindgärde F. Prevention of type 2 (non-insulin-dependent)
diabetes mellitus by diet and physical exercise. The 6-year Malmo feasibility
study. Diabetologia 1991;34:891-898.
16. Tuomilehto J, Lindstrom J, Eriksson JG, Valle TT, Hamalainen H, Ilanne-Parikka
P, et al. Prevention of type 2 diabetes mellitus by changes in lifestyle
among subjects with impaired glucose tolerance. N Engl J Med 2001;344:1343-1350.
17. Diabetes Prevention Program Research Group. Reduction in the incidence
of Type 2 diabets with lifestyle intervention or metformin. N Eng J Med
2002;346:393-403.
18. Bogardus C, Ravussin E, Robbins DC, Wolfe RR, Horton ES, Sims EA.
Effects of physical training and diet theraphy on carbohydrate metabolism
in patients with glucose intolerance and non-insulin-dependent diabetes
mellitus. Diabetes 1984;33:311-318.
19. Trovati M, Carta Q, Cavalot F, Vitali S, Banaudi C, Lucchina PG, et
al. Influence of physical training on blood glucose control, glucose tolerance,
insulin secretion, and insulin action in non-insulin-dependent diabetic
patients. Diabetes Care 1984;7:416-420.
20. Yamanouchi K, Shinozaki T, Chikada K, Nishikawa T, Ito K, Shimizu
S, et al. Daily walking compared with diet theraphy is useful means for
obese NIDDM patients not only to reduce body weight but also to improve
insulin sensitivity. Diabetes Care 1995;18:775-778.
21. Schneider SH, Amorosa LF, Khachadurian AK, Ruderman NB. Studies in
the mechanism of improved glucose control during regular exercise in type
2 diabetes. Diabetes Care 1984;15 (Suppl. 4):355-360.
22. Holloszy JO, Schultz J, Kusnierkiewicz J, Hagberg JM, Ehsani AA. Effects
of exercise on glucose tolerance and insulin resistance. Acta Med Scand
1986;Suppl 711:55-65.
23. Krotkiewski M, Lonnroth P, Mandroukas K, Wroblewski Z, Rebuffe-Scrive
M, Holm G, et al. The effects of physical training on insulin secretion
and effectiveness and on glucose metabolism in obesity and type 2 (non-insulin-dependent)
diabetes mellitus. Diabetologia 1985;28:881-890.
24. Rogers MA, Yamamoto C, King DS, Hagberg JM, Ehsani AA, Holloszy JO.
Improvement in glucose tolerance after 1 week of exercise in patients
with mild NIDDM. Diabetes Care 1988;11:613-618.
25. Maehlum S, Felig P, Wahren J. Splanchnic glucose and muscle glycogen
metabolism after glucose feeding during postexercise recovery. Am J Physiol
1978;235:E255-E260.
26. Coderre L, Kandror KV, Vallega G, Pilch PF. Identification and characterisation
of an exercise-sensitive pool of glucose transporters in skeletal muscle.
J Biol Chem 1995;270:27584-27588.
27. Thorell A, Hirshman MF, Nygren J, Jorfeldt L, Wojtaszewski JF, Dufresne
SD, et al. Exercise and insulin cause GLUT-4 translocation in human skeletal
muscle. Am J Physiol 1999;277:E733-E741.
28. Goodyear LJ, King PA, Hirshman MF, Thompson CM, Horton ED, Horton
ES. Contractile activity increases plasma membrane glucose transporters
in the absence of insulin. Am J Physiol 1990;258:E667-E672.
29. Aschenbach WG, Sakamoto K, Goodyear LJ. 5' adenosine monophosphate-activated
protein kinase, metabolism and exercise. Sports Med 2004;34:91-103.
30. Ruderman N, Prentki M. AMP kinase and malonyl-CoA: targets for therapy
of the metabolic syndrome. Nat Rev Drug Discov 2004;3:340-351.
31. Björntorp P, Fahlen M, Grimby G, Gustafson A, Holm J, Renström
P, et al. Carbohydrate and lipid metabolism in middle-aged, physically
well-trained med. Metabolism 1972;21:1037-1044.
32. Devlin JT, Hirshman M, Horton ED, Horton ES. Enhanced peripheral and
splanchnic insulin sensitivity in NIDDM men after single bout of exercise.
Diabetes 1987;36:434.
33. Hirshman MF, Wallberg-Henrikson H, Wardzala LJ, Horton ED, Horton
ES. Acute exercise increases the number of plasma membrane glucose transporters
in rat skeletal muscle. FEBS Lett 1988;238:235-239.
34. Ploug T, van Deurs B, Cushman SW, Ralston E. Analysis of GLUT4 distributiuon
in whole skeletal muscle fibers: Identification of distinct storage compartments
that are recruited by insulin and muscle contraction. J Cell Biol 1998;142:1429-1446.
35. Dela F, Ploug T, Handberg A, Petersen LN, Larsen JJ, Mikines KJ, et
al. Physical training increases muscle GLUT4 protein and mRNA in patients
with NIDDM. Diabetes 1994;43:862-865.
36. Kurth-Kraczek EJ, Hirshman MF, Goodyear LJ, Winder WW. 5' AMP-activated
protein kinase activation causes GLUT4 translocation in skeletal muscle.
Diabetes 1999;48:1667-1671.
37. Fisher JS, Gao J, Han DH, Holloszy JO, Nolte LA. Activation of AMP
kinase enhances sensitivity of muscle glucose transport to insulin. Am
J Physiol Endocrinol Metab 2002;282:E18-E23.
38. Rasmussen BB, Hancock CR, Winder WW. Postexercise recovery of skeletal
muscle malonyl-CoA, acetyl carboxylase, and AMP-activated protein kinase.
J Appl Physiol 1998;85:1629-1634.
39. Zong H, Ren JM, Young LH, Pypaert M, Mu J, Birnbaum MJ, et al. AMP
kinase is required for mitochondrial biogenesis in skeletal muscle in
response to chronic energy deprivation. Proc Natl Acad Sci U S A 2002;99:15983-15987.
40. Wu H, Kanatous SB, Thurmond FA, Gallardo T, Isotani E, Bassel-Duby
R, et al. Regulation of mitochondrial biogenesis in skeletal muscle by
CaMK. Science 2002;296:349-352.
41. Patti ME, Butte AJ, Crunkhorn S, Cusi K, Berria R, Kashyap S, et al.
Coordinated reduction of genes of oxidative metabolism in humans with
insulin resistance and diabetes: Potential role of PGC1 and NRF1. Proc
Natl Acad Sci U S A 2003;100:8466-8471.
42. Mootha VK, Lindgren CM, Eriksson KF, Subramanian A, Sihag S, Lehar
J, et al. PGC-1alpha-responsive genes involved in oxidative phosphorylation
are coordinately downregulated in human diabetes. Nat Genet 2003;34:267-273.
43. Petersen KF, Dufour S, Befroy D, Garcia R, Shulman GI. Impaired mitochondrial
activity in the insulin-resistant offspring of patients with type 2 diabetes.
N Eng J Med 2004;350:664-671.
44. Borghouts LB, Keizer HA. Exercise and insulin sensitivity: A review.
Intern J Sports Med 2000;21:1-12.
