
Gå tillbaka
Diabetes mitt emellan typ 1 och typ 2 – en verklighet där optimal behandling är osäker
Anneli Björklund, med dr
Valdemar Grill, professor
Sofia Carlsson, med dr
Leif Groop professor
Patienter med så kallad Latent Autoimmune Diabetes in the Adult (LADA) är den näst största gruppen av diabetespatienter i Sverige men samtidigt den minst undersökta och den där vi vet minst om vad som är bästa behandling. I denna artikel vill vi presentera kunskapsläget i stort kring LADA och peka på behovet av kliniska studier för att komma fram till optimal behandling av denna stora grupp av patienter.
Nuvarande klassificering av diabetes
De flesta patienter med diabetes mellitus klassificeras idag som antingen typ 1 eller typ 2 diabetes (1). En äldre klassificering skilde mellan insulinberoende och icke-insulinberoende diabetes. Klassificeringen ändrades i slutet av 90-talet till huvudgrupperna typ 1 och typ 2 diabetes. Härigenom skulle diabetes klassificeras utifrån orsaker istället för behandling. Skiljelinjen mellan typ 1 och typ 2 diabetes är tänkt att vara huvudsakligen autoimmuna orsaker för typ 1 diabetes och icke-autoimmuna orsaker för typ 2 diabetes. Bakgrund för autoimmunitetskriteriet är att flera decenniers forskning klart visat att autoimmunitet riktad mot de insulin-producerande betacellerna kan leda till total förlust av betaceller och därigenom insulinberoende. Typ 1 diabetes innefattar därför dem som tidigare fick diagnosen insulinberoende diabetes.
Typ 2 diabetes karaktäriseras av en kombination av insulinresistens och reducerad betacell funktion (2). Reducerad betacellfunktion gör att insulinfrisättningen inte är tillräcklig för att kompensera för insulinresistens. Välkända orsaker till insulinresistens är övervikt, låg fysisk aktivitet, låg födelsevikt och genetiska faktorer. Orsaker till reducerad insulinfrisättning är mindre väl utredda. Genetiska faktorer är betydelsefulla, liksom effekter av ålder och möjligen effekter av hyperglykemi och hyperlipidemi. Eftersom insulinfrisättningen trots allt är betydande vid typ 2 diabetes, åtminstone när diabetes upptäcks, finns inte ett akut behov av insulinbehandling. Typ 2 diabetes svarar därför i stort mot den tidigare benämningen icke-insulinberoende diabetes.
LADA har tidigare uppfattats som typ 2 diabetes men har tecken till autoimmunitet
Orsaker till typ 2 diabetes innefattar alltså per definition inte autoimmunitet. Emellertid är det sedan mitten av 80-talet känt att många patienter med nyupptäckt diabetes i vuxen ålder och utan behov av insulin (utifrån klinisk bedömning) har cirkulerande antikroppar mot betaceller av samma slag som de patienter som är insulinberoende från debut av sjukdomen, dvs. de med ”klassisk” typ 1 diabetes (3,4). Förstnämnda patienter har kallats LADA, en förkortning av Latent Autoimmune Diabetes in the Adult. Även om benämningen LADA har ifrågasatts (5)- eftersom diabetes ju inte är latent när den faktiskt har diagnostiserats - har begreppet LADA levt vidare.
Tilläggskriteria för LADA har varit att diabetesdebut sker efter 30-35 års ålder, samt att patienterna, utifrån klinisk bedömning, skall vara insulinoberoende minst 6 -12 månader efter diabetesdiagnos. Klinisk bedömning kan dock variera och därför är den angivna tidsperioden som diagnoskriterium under diskussion (5,6 ).
Hur pass betydelsefull är autoimmunitet hos LADA patienter?
Även om patienterna alltså utifrån klinisk bedömning inte behöver insulinbehandling under lång tid efter sjukdomsdiagnosen, så visar flera studier att LADA patienter som grupp utvecklar ett sådant behov efter kortare tid än patienter utan positivitet för antikroppar mot betacellsantigen, dvs. patienter som definitionsmässigt har typ 2 diabetes (7, 8). Detta förhållande talar starkt för betydelsen av autoimmun aktivitet för sjukdomsutvecklingen hos LADA.
En annan fråga är hur mycket autoimmunitet betyder för sjukdomsförloppet vis-a-vis andra faktorer och i vilken utsträckning betydelsen av autoimmunitet varierar från patient till patient. Den idag mest kända och utnyttjade markören för autoimmunitet riktad mot betaceller är anti GAD (GAD =Glutamic Acid Decarboxylase). I praktiken är förekomst av antiGAD idag avgörande för att skilja LADA från typ 2 diabetes. Från ”klassisk” typ 1 diabetes vet man att positivitet för antiGAD visserligen förkommer hos 80-90 % av nyupptäckta patienter, men att graden av positivitet (antikroppstiter) inte är direkt korrelerad med sjukdomsaktivitet, mätt som hur snabbt resterande insulinproduktion försvinner hos enskilda patienter (9). Det faktum att upp till 4 % av vuxna personer utan diabetes uppvisar positivitet för antiGAD (10) talar för att denna autoimmuna markör inte nödvändigtvis visar på en betydande skada på betacellerna som orsakas av autoimmunitet. Prospektiva studier där kliniskt förlopp registreras hos personer med anitkropps-positivitet men utan diabetes behövs för att ytterligare klargöra relationen mellan antiGAD och kliniskt betydelsefull påverkan på betacellerna.
LADA har likheter med typ 2 diabetes
LADA patienter skall, utifrån gällande autoimmunitets-kriterier, klassificeras som typ 1 diabetes. Det har dock visat sig att dessa patienter när det gäller fenotypen liknar patienter med typ 2 diabetes (6,11). I en populationsbaserad epidemiologisk studie i Nord-Tröndelag (11) fann vi alltså att patienter med LADA i betydande grad var överviktiga och att en majoritet uppfyllde kriterier på så kallat metabolt syndrom. Övervikt, låg fysisk aktivitet och ökande ålder är välkända och viktiga riskfaktorer för typ 2 diabetes.
Vi fann att dessa faktorer är associerade med lika stor risk för LADA som för typ 2 diabetes. Däremot var de nämnda riskfaktorerna inte associerade med ökad risk för att utveckla ”klassisk” typ 1 diabetes. När det gäller senkomplikationer så talade data från samma epidemiologiska studie för att utsöndring av albumin i urin följer samma mönster för LADA som för typ 2 diabetes (12). De fenotypiska likheterna med typ 2 diabetes bidrar till att man, enligt vår mening, bör särskilja LADA patienter från patienter med ”klassisk” typ 1 diabetes.
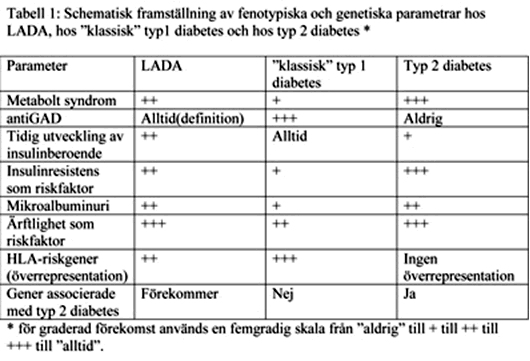
Vad betyder ärftlighet för LADA?
Nya data visar på att diabetes i nära släkt är associerad med flera gånger ökad risk för utveckling av LADA, precis som för typ 2 och typ 1 diabetes (13). När det gäller det genetiska orsaksmönstret för LADA har man tidigare funnit association till några av de HLA haplotyper som är kopplade till autoimmunitet vid ”klassisk” typ 1 diabetes (6) och reducerad association till protektiva HLA-haplotyper (14). Helt nyligen har det emellertid visats association till TCF7L2, en gen som är kopplad till betydligt ökad risk för typ 2 diabetes - men inte till risk för ”klassisk” typ 1 diabetes (15)
Fenotypiska och genetiska förhållanden för LADA vis-a-vis ”klassisk” typ 1 diabetes och vis-a-vis typ 2 diabetes sammanfattas schematiskt i tabell 1. Det finns alltså starka hållpunkter för att LADA verkligen är både en fenotypisk och genetisk ”mix” av ”klassisk” typ 1 och av typ 2 diabetes. Detta kan möjligen försvara den av andra föreslagna benämningen ”typ 1.5 diabetes”. Det återstår dock mycket att klarlägga när det gäller riskfaktorer och utveckling av diabetessjukdomen hos LADA.
Hur skall LADA-patienter behandlas?
Kliniskt viktigast är att klarlägga om optimal behandling av LADA patienter skiljer sig från typ 2 diabetes. Särskilt betydelsefullt är att om möjligt finna behandling som kan förebygga eller fördröja nedgången i patienternas insulinfrisättning, en nedgång som i tidigare studier skett snabbare hos LADA än hos patienter med typ 2 diabetes (7, 8).
Eftersom de flesta personer som nu diagnostiseras som LADA är överviktiga och därigenom insulinresistenta är det motiverat med livsstilsförändringar och behandling med farmaka som ökar känsligheten för insulin, alltså i första hand metformin. En sådan rekommendation förefaller okontroversiell. Kontroversiell är däremot frågan om insulinbehandling skall startas utifrån samma kliniska bedömning som för typ 2 diabetes, eller påbörjas tidigare hos LADA-patienter. För ”klassisk” typ 1 diabetes har man visat att intensiv insulinbehandling bevarar resterande insulinproduktion bättre än konventionell insulinbehandling (16).
När det gäller LADA jämförde en japansk studie behandling med sulfonylurea (glibenklamid) med insulinbehandling (17) Insulinbehandling påbörjades när patienterna ännu inte var kliniskt i behov av insulin. Man fann att egen insulinproduktion bevarades längre efter insulinbehandling än efter glibenklamid. Ett teoretiskt underlag för den gynnsamma effekten av tidig insulinbehandling är att betacellerna genom att avlastas fungerar bättre och dessutom är mindre känsliga för autoimmun aktivitet och/eller ger upphov till mindre aktivitet.
Emellertid var den japanska studien liten. Gynnsamma resultat av insulinbehandling jfr med sulfonylurea mätt som metabol kontroll (HbA1c) kunde inte reproduceras i den stora engelska undersökningen ( UK Prospective Study (UKPDS) (18). Dock var kriterier för god metabol kontroll helt annorlunda (mindre strikta) i UKPDS – studien än vad som är fallet idag; vidare kunde man inte jämföra insulinfrisättning i de olika behandlingsgrupperna. Huruvida tidig insulinbehandling hos LADA patienter är bättre än tilläggsbehandling som ökar insulinfrisättningen är alltså per idag oklart.
Låt oss understryka att det här rör sig om en mycket stor patientgrupp som i olika epidemiologiska studier utgör ca 10 % av patienter med diabetes (6,8,11). LADA patienter är alltså fler till antalet än patienter med ”klassisk” typ 1 diabetes och LADA är därför den vanligaste diabetesformen näst efter typ 2 diabetes i Sverige och många andra länder. Att säkerställa optimal diabetesbehandling av LADA är alltså betydelsefullt för väldigt många diabetespatienter. Det är därför angeläget att starta en större klinisk studie där insulinalternativet jämförs med dagens bästa möjliga behandling med insulinfrisättande farmaka. Planläggning för en sådan multicenterstudie i Sverige och Norge pågår för närvarande.
Anneli Björklund, med dr Endokrinologiska Kliniken, Karolinska Sjukhuset, Valdemar Grill, professor Endokrinologisk Avdelning, Universitetssjukhuset i Trondheim, Norge, Sofia Carlsson, med dr, epidemiolog, Institutet för Miljömedicin, Karolinska Institutet, Leif Groop professor Endokrinologiska Kliniken, Malmö Allmänna Sjukhus
Publiceras med tillstånd av Läkartidningen och författarna.
Nyhetsinfo 080521
www Red DiabetologNytt
Referenser
1).. World Health Organization. Definition, diagnosis and classification of diabetes mellitus and its complications. Part 1 Diagnosis and classification of diabetes mellitus. Geneva: Department of Non-communicable Disease Surveillance, WHO, 1999.
2).. Stumvoll M, Goldstein BJ, van Haeften TW. Type 2 diabetes: principles of pathogenesis and therapy. Lancet. 2005;365:1333-46,
3).. Groop LC, Bottazzo GF, Doniach D. Islet cell antibodies identify latent type I diabetes in patients aged 35-75 years at diagnosis. Diabetes. 1986;35:237-41
4).. Tuomi T, Groop LC, Zimmet PZ, Rowley MJ, Knowles W, Mackay IR. Antibodies to glutamic acid decarboxylase reveal latent autoimmune diabetes mellitus in adults with a non-insulin-dependent onset of disease. Diabetes. 1993; 42:359-62,
5).. Gale EA. Latent autoimmune diabetes in adults: a guide for the perplexed. Diabetologia. 2005;48:2195-9,
6).. Fourlanos S, Dotta F, Greenbaum CJ, Palmer JP, Rolandsson O, Colman PG, Harrison LC. Latent autoimmune diabetes in adults (LADA) should be less latent. Diabetologia. 2005;48:2206-12,.
7).. Gottsäter A, Landin-Olsson M, Lernmark A, Fernlund P, Sundkvist G, Hagopian WA. Glutamate decarboxylase antibody levels predict rate of beta-cell decline in adult-onset diabetes. Diabetes Res Clin Pract. 1995;27:133-40
8).. Turner R, Stratton I, Horton V, Manley S, Zimmet P, Mackay IR, Shattock M, Bottazzo GF, UKPDS 25: autoantibodies to islet-cell cytoplasm and glutamic acid decarboxylase for prediction of insulin requirement in type 2 diabetes. UK Prospective Diabetes Study Group. Lancet. 1997; 350(9087):1288-93.
9).. Leslie RD, Atkinson MA, Notkins AL. Autoantigens IA-2 and GAD in Type I (insulin-dependent) diabetes. Diabetologia. 1999;42:3-14,
10) Tuomi T, Carlsson A, Li H, Isomaa B, Miettinen A, Nilsson A, Nissén M, Ehrnström BO, et al.Clinical and genetic characteristics of type 2 diabetes with and without GAD antibodies. Diabetes. 1999; 48:150-7.
11) Carlsson S, Midthjell K, Grill V. Age, overweight and physical inactivity increase the risk of latent autoimmune diabetes in adults (LADA). Results from the Nord-Trøndelag Health Study. Diabetologia. 2007;50:55-8.
12) Radtke M, Lund Nilsen TI, Midthjell K, Grill V. Close similarities in urinary albumin excretion between type 2 diabetes and LADA versus type 1diabetes – results from the Nord-Trøndelag Health Study 1995-97 (HUNT2). Diabetologia 2007;50:Suppl 1, S158-59, (Abstract)
13) Carlsson S, Midthjell K, Grill V. Influence of family history of diabetes on incidence and prevalence of latent autoimmune diabetes of the adult (LADA). Results from the Nord-Trondelag health study. Diabetes Care. 2007;30(12):3040-5.
14) Stenström G, Berger B, Borg H, Fernlund P, Dorman S, Sundkvist G. HLA-DQ genotypes in classic type 1 diabetes and Latent Autoimmune Diabetes in the Adult. Am J Epidemiology. 2002;156:787-796
15) Cervin C, Lyssenko V, Lindholm E, Bakhtadze E, Nilsson
|Upp|
